近年来,细菌耐药已成为全球面临的严峻问题,耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii,CRAB)全世界流行,耐碳青霉烯类肠杆菌科细菌(CRE)逐年增长,美国疾病控制与预防中心(CDC)已将CRE、CRAB分别列为耐药挑战的最紧急级别和严重威胁级别[1]。多重耐药菌(multidrug-resistant organism, MDRO)的治疗已成为当前抗感染领域面临的重大挑战,尤其是泛耐药菌(extensively drug-resistant organism, XDRO)。重症监护病房(ICU)是泛耐药鲍曼不动杆菌(XDR-AB)感染和泛耐药肺炎克雷伯菌(XDR-KP)感染的高发病区,XDR-AB、XDR-KP所致重症肺炎尤为多见。此类患者通常病情危重,XDR-AB和XDR-KP感染所致病死率分别达42.8%~61.3%[2-3]和28.7%~32%[4-5]。针对重症肺炎患者选择合适的抗菌药物是治疗成功的关键因素,同时亦是临床医生面临的一大难题。
多粘菌素是一种非核糖体类抗生素,主要通过破坏细胞膜的完整性,起到快速杀菌作用。曾被临床广泛应用于抗革兰阴性菌治疗,后因其抗菌谱窄,毒副作用明显而逐渐被替代。目前,随着全球范围内多重耐药革兰阴性菌感染率不断增高,多粘菌素作为治疗革兰阴性菌感染的最后一道防线再次被重视。中国鲍曼不动杆菌感染诊治与防控专家共识、广泛耐药革兰阴性菌感染的中国专家共识均推荐以多粘菌素为基础的联合治疗方案作为治疗选择之一[6-7]。
目前临床使用的多粘菌素有两种:多粘菌素B和多粘菌素E。与多粘菌素E相比,多粘菌素B具有优异的药代动力学效应,但由于药物资源有限,多粘菌素B相关临床资料以及临床治疗经验相对缺乏。因此,本研究以我院ICU XDR-AB和/或XDR-KP重症肺炎患者为研究对象,给予以多粘菌素B为基础的联合治疗,评价其治疗效果、耐受性及不良反应,并比较鲍曼不动杆菌和肺炎克雷伯菌微生物清除率,旨在总结以多粘菌素B为基础的联合治疗方案对XDR-AB和XDR-KP重症肺炎的临床治疗经验。
1 资料与方法 1.1 临床资料选择2018年4月1日—2019年4月30日在本院ICU住院并经病原学检查证实为XDR-AB和/或XDR-KP重症肺炎,且选择以多粘菌素B为基础的联合抗感染治疗方案的患者为研究对象;按入组时痰液培养菌株将患者分成鲍曼不动杆菌组(GA)和肺炎克雷伯菌组(GK)。纳入标准:(1)年龄≥18岁;(2)微生物检查证实为XDR-AB和/或XDR-KP重症肺炎,且予多粘菌素B联合抗感染治疗方案>3 d。排除标准:(1)年龄<18周岁;(2)孕妇;(3)治疗时间≤3 d。
重症肺炎诊断参照美国感染疾病协会/美国胸科协会诊断标准:符合以下1项主要标准或3项以上次要标准。主要标准:(1)需要有创机械通气;(2)感染性休克需要血管活性药物治疗;次要标准:(1)呼吸频率≥30次/分;(2)氧合指数≤250;(3)多叶肺浸润;(4)低体温(T<36℃);(5)白细胞减少(WBC<4×109/L);(6)血小板减少(<10×109/L);(7)低血压,需要强力的液体复苏;(8)意识障碍、定向障碍;(9)氮质血症(BUN≥20 mg/dL)。XDR-AB或XDR-KP重症肺炎的诊断:符合上述重症肺炎的诊断标准,且痰培养为XDR-AB和/或XDR-KP。泛耐药定义:除1~2类抗菌药物(主要指多粘菌素类和替加环素)外,几乎对所有类别抗菌药物不敏感[7]。
1.2 治疗方法及监测指标 1.2.1 给药方案所有患者均采用以多粘菌素B(上海第一生化药业有限公司生产)为基础的联合治疗;多粘菌素B剂量按照患者实际体重进行计算[首剂负荷量1.5万U/kg,维持量2万U/(kg·d)每日剂量分两次给予]。联合使用的药物有碳青霉烯类、β内酰胺类酶抑制剂和替加环素。使用过程中出现急性肾损伤(AKI)达到KDIGO分期3期或肌酐清除率(Ccr)<30 mL/min,根据临床医生经验判断必须继续使用多粘菌素B治疗,且同时行持续肾脏替代治疗(CRRT)时,多粘菌素B剂量不予调整。
1.2.2 微生物定期监测治疗过程中第1、3、5、7、9、11、13、15天分别送检痰培养及药敏,从而了解微生物清除情况及对多粘菌素B敏感性的变化。
1.2.3 临床指标监测每日监测体温峰值,治疗过程第1、3、5、7、9、11、13、15天送检血常规、肝功能、肾功能、C反应蛋白(CRP),第1、5、10、15天送检血降钙素原(PCT)。
1.3 治疗效果观察评价 1.3.1 临床治疗效果评价临床治疗效果主要依据发热热峰、痰量及性状、肺部啰音、血WBC、CRP、PCT、胸部CT或胸部X线检查表现等进行CPIS评分,并由两位高年资经治医生进行评价。
1.3.2 微生物学评价观察XDR-AB、XDR-KP对多粘菌素B的敏感情况,同时比较GA和GK的微生物清除率。连续两次痰培养目标细菌转阴判定为微生物清除。
1.3.3 不良反应评价观察有无肝肾功能损害,观察有无皮肤黑色素沉着以及其他不良反应。参照KDIGO指南定义,以血肌酐值较基础值升高1.5倍为急性肾损伤。以丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)升高2倍以上为急性肝功能损害。
1.4 统计分析应用SPSS 24.0对所有数据进行统计处理,正态分布计量资料以x±s表示,采用t检验;四格表计数资料采用Fisher精确检验,列联表计数资料采用卡方检验,P≤0.05认为差异具有统计学意义。
2 结果 2.1 一般资料共入选24例患者,进行26例次目标性抗感染治疗,其中2例患者在病程的不同时期分别接受2次治疗。24例患者中男性18例,女性6例;APACHEII评分为(16.8±3.7)分,年龄为(61.5±19.8)岁。治疗时间6~26 d, 平均为(12.7±4.9) d。26例次抗感染治疗中13例次为单一鲍曼不动杆菌感染,3例次为单一肺炎克雷伯菌感染,10例次为鲍曼不动杆菌和肺炎克雷伯杆菌混合感染。入组时XDR-AB、XDR-KP均对多粘菌素B敏感,对替加环素敏感、中介或耐药,对其余抗菌药物均耐药。
2.2 临床治疗效果和微生物学效果 2.2.1 临床治疗效果26例次联合抗感染治疗,19例次治疗临床有效,7例次无效,治疗有效率73.1%。
2.2.2 微生物学结果治疗过程中动态送检痰进行培养,139次痰培养XDR-AB或XDR-KP阳性,药敏结果示138次对多粘菌素B敏感(MIC 0.5~1 μg/mL),仅1次耐药(MIC=8 μg/mL),耐药率为0.7%;该次耐药为XDR-AB肺炎患者在多粘菌素B联合治疗9 d后检测结果。
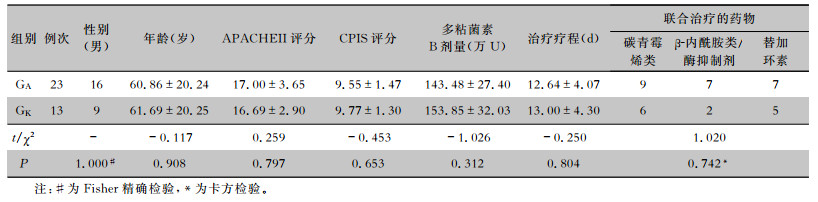
GA和GK患者年龄、APACHEII评分、CPIS评分、多粘菌素B治疗剂量、疗程、联合治疗各组比较,差异均无统计学意义(均P>0.05)。见表 1。GA细菌清除率(60.9%,14/23)高于GK(7.7%,1/13),差异有统计学意义(P=0.004)。GA平均清除时间为(7.33±4.74) d,而GK仅1例肺炎克雷伯菌清除,清除时间是10 d。
| 表 1 两组患者一般资料比较 Table 1 Comparison of general data between two groups of patients |
|
26例次治疗过程中11例次在使用多粘菌素B后新发AKI,AKI发病率42.3%。因AKI提前终止药物治疗1例次,行CRRT治疗3例次。新发AKI发生于用药后3~14 d,平均(7.7±4.1)d,并于AKI发生后2~6 d达损害高峰,肾功能恢复者肾损伤的持续时间5~35 d,平均(17.0±11.9)d。AKI严重度:AKI 1期4例次,AKI 2期3例次,AKI 3期4例次;所有存活患者(存活率60.0%),包括1例AKI 3期在内,肾功能均逐步恢复至正常。24例感染患者中5例患者(20.8%)发生皮肤黑色素沉着,所有患者均未发生药物相关性肝功能损害以及其他不良反应。
3 讨论自二十一世纪以来,鲍曼不动杆菌和肺炎克雷伯菌成为威胁重症患者最主要的病原体,并且其耐药率也呈快速增长[8-9]。此两种细菌被列入难以消灭的医院感染病原微生物“ESKAPE”之列[10]。由于新型抗生素的缺乏,多粘菌素重新回到了临床医生的视野[11-13],并成为近十年来针对泛耐药革兰阴性杆菌(XDR-GNB)的最后一道防线[14]。
本研究中26例次泛耐药鲍曼不动杆菌和/或肺炎克雷伯菌重症肺炎均予以多粘菌素B为基础的联合抗感染治疗方案,结果显示临床治疗有效率达73.1%。Lee等[15]发现给予产碳青霉烯酶的肺炎克雷伯菌(CRKP)脓毒症患者以多粘菌素B为基础的联合治疗,治疗成功率为71%;泰国一项关于多粘菌素B治疗XDR-GNB感染的研究显示,多粘菌素B联合治疗的临床治疗有效率达78.1%[16],本研究结果与以上结果接近,提示以多粘菌素B为基础的联合治疗是XDR-AB、XDR-KP感染的有效治疗手段。
既往研究[17]表明,多粘菌素B单药治疗不易达到有效血药浓度,且易导致异质性耐药, 联合治疗可以预防或延缓异质性耐药发生。本研究中经联合治疗方案抗感染6~26 d,XDR-AB、XDR-KP对多粘菌素B耐药率仅为0.7%,提示联合治疗对维持细菌对多粘菌素B的敏感性具有一定作用。然而,尽管药物敏感性良好,临床有效治疗率较高,但XDR-AB细菌清除率为60.9%,XDR-KP细菌清除率仅为7.7%。主要考虑细菌清除过程极其复杂,除需要敏感的抗菌药物治疗,还涉及细菌自身黏附力、理化特性、机体免疫细胞吞噬拓清能力等。目前尚缺乏有关多粘菌素B对两种细菌清除率差异性的相关研究,但肺炎克雷伯菌清除率低的现象需特别重视,提示即使临床治疗有效,但细菌仍处于定植状态,医院感染防控不能松懈,时刻警惕细菌由定植状态转化为感染。
既往研究[16, 18]显示,多粘菌素B相关的AKI发病率为24.7%~54.9%;发生AKI距离开始用药时间为(10.68±9.93)d,AKI持续时间为(17.27±20.16)d。本研究发现使用多粘菌素B后AKI发病率42.3%,最早发生在用药后第3天,平均时间为(7.7±4.1)d,肾功能恢复者AKI持续时间为(17.0±11.9)d。本研究结果表明,多粘菌素B所致的AKI发生率高,且发生时间较早,持续时间较长,临床医生在用药后应动态监测肾功能。
Gomes等[19]对多粘菌素B治疗后存活时间>30 d的患者进行1年随访,结果发现33%的AKI者肾功能可以恢复正常;同时研究[18]报道,多粘菌素B相关AKI的肾功能恢复率39.39%。本研究中存活者肾功能均逐步恢复至正常,恢复率(60.0%)高于上述研究结果。推测原因可能与本研究入组均为危重症患者,治疗过程对肾功能进行密切监测,部分患者处于AKI早期时即被发现,并尽量避免使用其他肾损伤药物有关。综合以上结果,可以推测多粘菌素B所致AKI一般为可逆性,且可能与预后相关。因此,在减少或避免肾功能损害的同时,积极控制感染改善患者预后,肾功能可能更好地恢复。
本研究存在以下不足:(1)样本量相对偏小;(2)研究未设立其他抗感染方案作为对照组进行临床效果和微生物学效果的比较;(3)未能对不同细菌组给予不同联合治疗方案进行临床效果和微生物学效果的亚组分析,上述不足将有待于后期进行深入的临床研究。
综上所述,本研究通过观察XDR-AB、XDR-KP重症肺炎给予以多粘菌素B为基础的联合治疗,发现该治疗方案临床有效率高,MDRO对多粘菌素B的敏感性良好,但细菌清除率相对较低,需警惕细菌由定植转化为感染;多粘菌素B的不良反应主要为肾毒性,但对于感染得到控制的存活者,肾损伤一般为可逆性,使用期间应当加强对肾功能的监测,避免同时使用其他肾损伤药物。本研究为以多粘菌素B为基础的联合治疗提供了宝贵的临床经验,为XDR-AB、XDR-KP重症肺炎患者选择合理的抗菌药物治疗提供了临床支持依据。
| [1] |
Karam G, Chastre J, Wilcox MH, et al. Antibiotic strategies in the era of multidrug resistance[J]. Crit Care, 2016, 20(1): 136. DOI:10.1186/s13054-016-1320-7 |
| [2] |
Li YJ, Pan CZ, Fang CQ, et al. Pneumonia caused by extensive drug-resistant Acinetobacter baumannii among hospitalized patients:genetic relationships, risk factors and mortality[J]. BMC Infect Dis, 2017, 17(1): 371. DOI:10.1186/s12879-017-2471-0 |
| [3] |
iginskienė A, Dambrauskiene·A, Rello J, et al. Ventilator-associated pneumonia due to drug-resistant Acinetobacter baumannii:risk factors and mortality relation with resistance profiles, and independent predictors of in-hospital mortality[J]. Medicina (Kaunas), 2019, 55(2): 49. DOI:10.3390/medicina55020049 |
| [4] |
Wang Z, Qin RR, Huang L, et al. Risk factors for carbape-nem-resistant Klebsiella pneumoniae infection and mortality of Klebsiella pneumoniae infection[J]. Chin Med J (Engl), 2018, 131(1): 56-62. DOI:10.4103/0366-6999.221267 |
| [5] |
Liu B, Yi H, Fang J, et al. Antimicrobial resistance and risk factors for mortality of pneumonia caused by Klebsiella pneumoniae among diabetics:a retrospective study conducted in Shanghai, China[J]. Infect Drug Resist, 2019, 12: 1089-1098. DOI:10.2147/IDR.S199642 |
| [6] |
陈佰义, 何礼贤, 胡必杰, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志, 2012, 92(2): 76-85. |
| [7] |
王明贵. 广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制:中国专家共识[J]. 中国感染与化疗杂志, 2017, 17(1): 82-92. |
| [8] |
Sanchez GV, Master RN, Clark RB, et al. Klebsiella pneumoniae antimicrobial drug resistance, United States, 1998-2010[J]. Emerg Infect Dis, 2013, 19(1): 133-136. DOI:10.3201/eid1901.120310 |
| [9] |
Hoffmann MS, Eber MR, Laxminarayan R. Increasing resis-tance of Acinetobacter species to imipenem in United States hospitals, 1999-2006[J]. Infect Control Hosp Epidemiol, 2010, 31(2): 196-197. DOI:10.1086/650379 |
| [10] |
Rice LB. Federal funding for the study of antimicrobial resis-tance in nosocomial pathogens:no ESKAPE[J]. J Infect Dis, 2008, 197(8): 1079-1081. DOI:10.1086/533452 |
| [11] |
Biswas S, Brunel JM, Dubus JC, et al. Colistin:an update on the antibiotic of the 21st century[J]. Expert Rev Anti Infect Ther, 2012, 10(8): 917-934. DOI:10.1586/eri.12.78 |
| [12] |
Vincent JL, Rello J, Marshall J, et al. International study of the prevalence and outcomes of infection in intensive care units[J]. JAMA, 2009, 302(21): 2323-2329. DOI:10.1001/jama.2009.1754 |
| [13] |
Zavascki AP, Goldani LZ, Cao G, et al. Pharmacokinetics of intravenous polymyxin B in critically ill patients[J]. Clin Infect Dis, 2008, 47(10): 1298-1304. DOI:10.1086/592577 |
| [14] |
Nation RL, Velkov T, Li J. Colistin and polymyxin B:peas in a pod, or chalk and cheese?[J]. Clin Infect Dis, 2014, 59(1): 88-94. |
| [15] |
Lee GC, Burgess DS. Treatment of Klebsiella pneumoniae carbapenemase (KPC) infections:a review of published case series and case reports[J]. Ann Clin Microbiol Antimicrob, 2012, 11: 32-41. DOI:10.1186/1476-0711-11-32 |
| [16] |
Ngamprasertchai T, Boonyasiri A, Charoenpong L, et al. Effectiveness and safety of polymyxin B for the treatment of infections caused by extensively drug-resistant gram-negative bacteria in Thailand[J]. Infect Drug Resist, 2018, 11: 1219-1224. DOI:10.2147/IDR.S169939 |
| [17] |
Bergen PJ, Bulman ZP, Saju S, et al. Polymyxin combinations:pharmacokinetics and pharmacodynamics for rationale use[J]. Pharmacotherapy, 2015, 35(1): 34-42. |
| [18] |
Quintanilha JCF, Duarte NDC, Lloret GR, et al. Colistin and polymyxin B for treatment of nosocomial infections in intensive care unit patients:pharmacoeconomic analysis[J]. Int J Clin Pharm, 2019, 41(1): 74-80. DOI:10.1007/s11096-018-0766-x |
| [19] |
Gomes EC, Falci DR, Bergo P, et al. Impact of polymyxin-B-associated acute kidney injury in 1-year mortality and renal function recovery[J]. Int J Antimicrob Agents, 2018, 52(1): 86-89. DOI:10.1016/j.ijantimicag.2018.02.016 |



