2. 山西医科大学公共卫生学院, 山西 太原 030009
2. Department of Public Health, Shanxi Medical University, Taiyuan 030009, China
维生素D是对儿童生长发育至关重要的脂溶性维生素,是类固醇类激素超家族中的一员。维生素D除调节钙磷代谢,维持骨骼健康的经典作用外,还具有重要的免疫调节和抗感染作用。维生素D低水平与多种感染性疾病的发生、进展相关,维生素D增补被用于治疗与预防多种感染性疾病。儿童生长发育迅速,对维生素D需求量大,结合阳光暴露不足,家庭对维生素D增补重视不够等因素,易导致儿童维生素D缺乏, 是维生素D缺乏的高危人群。儿童维生素D营养状况评估,早期诊断维生素D缺乏与不足及精准增补对儿童维生素D缺乏预防和感染性疾病防治极为重要。本文就维生素D营养状况与儿童感染性疾病的相关性及其抗感染机制进行简要综述。
1 维生素D及其营养状况评估维生素D是对儿童生长发育至关重要的脂溶性维生素,也是生物学效应广泛的一种类固醇激素。儿童体内的维生素D通过内源合成和外源摄入两种途径获得[1]。内源性维生素D3主要由表皮和真皮层的7-脱氢胆固醇经紫外线照射转变而来。大部分天然食物只含有极少量维生素D,外源摄入的维生素D(维生素D3和D2)主要来源于强化剂或强化食物。儿童常用的维生素D强化剂(强化食物)包括婴幼儿配方奶、鱼肝油、伊可新及多种维生素混合补充剂等[2-3]。维生素D含量相对丰富的天然食物包括鳕鱼、金枪鱼(230 IU/100 g)、鲭鱼(250 IU/100 g)等鱼类,以及奶类和动物肝脏等[2]。吸收入血的维生素D通过与结合蛋白结合而运输到肝,在肝内经25α羟化酶作用转化为25-羟维生素D (25-OH-D),随后转运至表达1α羟化酶(CYP27B1)的肾、淋巴细胞、抗原提呈细胞等,经CYP27B1催化转化为1, 25-二羟维生素D (1, 25-OH2-D),即维生素D的活性形式[4]。1, 25-OH2-D与位于靶器官内的维生素D受体(vitamin D receptor, VDR)结合,发挥其调节免疫细胞功能,调节基因表达等多方面作用。25-OH-D因其在血液中浓度高,半衰期长,更加稳定等特点,被认为是维生素D营养状况评估的最佳指标[5]。因维生素D生物学效应广泛,目前对血清25-OH-D的最佳生物参考区间尚有争议。依据2016版佝偻病全球共识[6],仅从钙磷代谢及骨骼健康角度,维生素D营养状况评估标准为:充足,血清25-OH-D>20 ng/mL;不足,12 ng/mL≤25-OH-D≤20 ng/mL; 缺乏:25-OH-D<12 ng/mL。
2 维生素D与儿童感染性疾病的相关性维生素D低水平与儿童多种感染性疾病相关。维生素D缺乏与儿童呼吸道疾病的相关性最早在结核病中被发现,患有肺结核病或处于潜伏期的结核病儿童血清维生素D水平低于正常对照组,且用富含维生素D的鳕鱼肝油治疗可改善疾病预后[7]。此外,维生素D不足还是急性呼吸道感染(acute respiratory infection, ARI)、胃肠道感染的风险因素,Science等[8]调查了加拿大743名3~15岁罹患上呼吸道感染的儿童,结果显示随着维生素D缺乏程度的增加,罹患上呼吸道感染的风险也增加。Berry等[9]回顾性研究表明,血清25-OH-D水平与ARI发病率呈负相关,与肺功能呈正相关,血清25-OH-D每增加10 nmol/L,呼吸道感染风险降低7%,而1 s内强制呼气量(FEV1)可增加8 mL。Thornton等[10]发现维生素D缺乏儿童发生胃肠道感染的次数(呕吐、腹泻)高于维生素D充足的对照组儿童。脓毒症相关荟萃性研究[11]表明,儿童维生素D缺乏和脓毒症发病率及疾病严重程度之间有明显的相关性。早发型脓毒症新生儿(足月新生儿)血清25-OH-D水平低于健康对照组,且血清25-OH-D水平与C反应蛋白水平(C-reactive protein, CRP)呈负相关[12]。近年来研究发现,维生素D水平与儿童中耳炎发病相关。中耳炎患儿血清25-OH-D水平低于对照组健康儿童[13],患复发性中耳炎疾病儿童维生素D缺乏常见,当血清25-OH-D水平<30 ng/mL时复发性中耳炎发生率增加[14]。维生素D水平与儿童感染性疾病相关性病例对照研究结果见表 1。
| 表 1 维生素D水平与儿童感染性疾病相关性病例对照研究结果 |
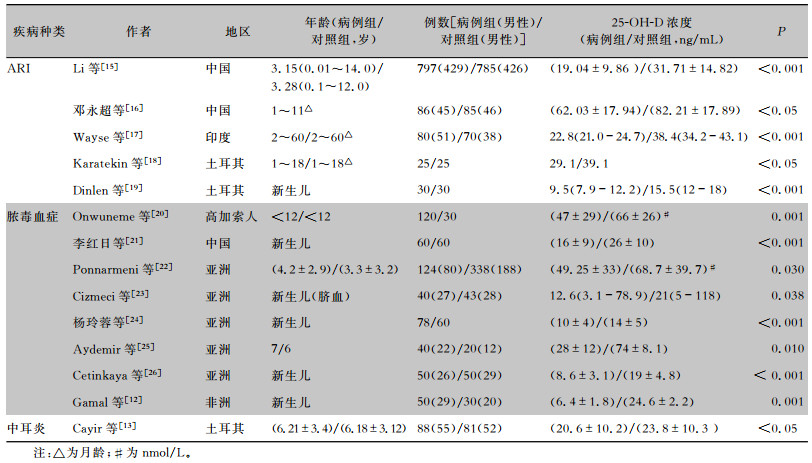
|
早在1000多年前,日光浴就被用于治疗结核病[27]。近年来多种感染性疾病伴随维生素D低水平被更多的发现和关注,维生素D增补被应用于一些感染性疾病的治疗与预防。维生素D(300 IU/d)干预组儿童ARI发病率低于安慰剂组儿童[28],在先前患有哮喘的儿童中,补充维生素D可使哮喘加重的风险降低74%[29],维生素D补充组(1 200 IU/d, 12月—次年3月份,补充时间为4个月)儿童冬季甲型流感的发生率低于安慰剂组儿童[30]。Hagag等[31]学者对60例脓毒症新生儿进行研究,显示抗菌药物联合维生素D增补组新生儿在治疗后第3、7、10天时,脓毒症评分和超敏C反应蛋白(hypersensitive C-reactive protein, Hs-CRP)水平均低于单纯抗菌药物治疗组(P<0.05),提示维生素D增补有助于减轻疾病进展。复发性中耳炎患儿(6个月内发作次数≥3次或12个月内发作次数≥4次)的随机双盲对照试验表明,维生素D治疗组(1 000 IU/d,补充时间为4个月)复发次数明显低于对照组(P<0.05)[32]。见表 2。
| 表 2 儿童感染性疾病维生素D干预试验结果 |
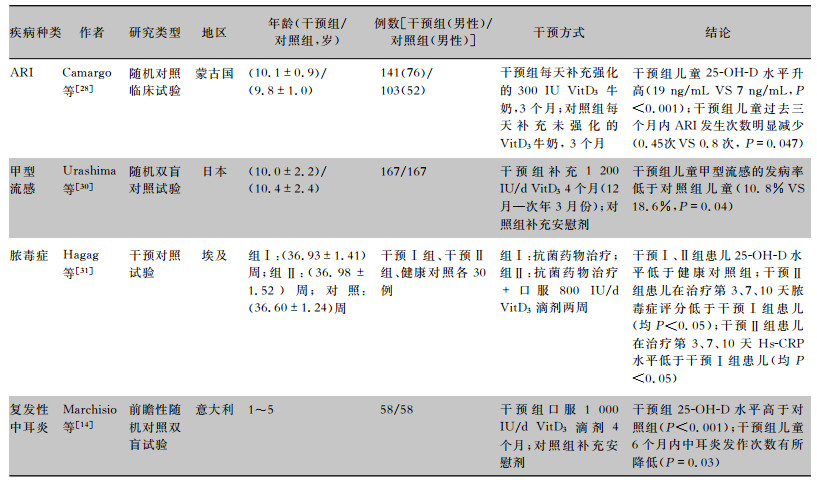
|
维生素D发挥抗感染机制是通过与免疫细胞上的维生素D受体VDR结合发挥作用。几乎所有类型的免疫细胞均表达VDR,VDR分为核受体(nVDR)和膜受体(mVDR)[32]。1, 25-OH2-D通过与位于细胞核的VDR结合,发挥其对免疫细胞和炎性细胞因子的调节、激活和增殖作用。核维生素D受体(nVDR)属于配体依赖性转录因子,1, 25-OH2-D与nVDR结合后,进一步与维甲酸核受体(RXR)结合,所形成的1, 25-OH2-D-VDR-RXR复合物特异性结合位于靶基因的维生素D反应原件(VDREs),进而调控与影响相关基因的转录与表达[33]。体外试验表明,使用1, 25-OH2-D处理CD4+T细胞后,102个基因的表达发生改变,其中57个基因表达下调,45个基因表达上调。除与nVDR结合发挥免疫调节作用外,1, 25-OH2-D还与膜维生素D受体(mVDR)结合,通过蛋白激酶C(PKC)、丝裂原活化蛋白激酶(MAPK)等信号通路调节免疫细胞的增殖、分化与凋亡[34]。
维生素D在先天性免疫反应中主要通过抗菌肽发挥抗感染作用。VDR/RXR转录因子复合体介导的Cathelicidin抗菌肽基因的表达是维生素D抗菌活性的主要机制。人体内的Cathelicidin抗菌肽,是由存在于人体各种上皮细胞(如皮肤、呼吸道和胃肠道)及免疫系统细胞(包括中性粒细胞、单核细胞、巨噬细胞)中的抗菌蛋白hcap-18裂解产生的。感染状态下,病原体与这些细胞表面Toll样受体及1α羟化酶结合,诱导维生素D活化成有活性的1, 25-OH2-D,1, 25-OH2-D随后上调人体抗菌蛋白hcap-18的mRNA表达,产生Cathelicidin。Cathelicidin对革兰阳性和革兰阴性菌以及各种病毒和真菌均显示出抗微生物活性。Cathelicidin杀伤机制是引起微生物膜的失稳,影响细胞膜的通透性,导致病原体裂解[35]。
维生素D在适应性免疫反应中主要通过抗原提呈细胞及T淋巴细胞等靶细胞发挥抗感染作用。树突状细胞是体内功能最强的抗原呈递细胞,是机体适应性免疫应答的启动者。采用1, 25-OH2-D刺激树突状细胞,可导致抗炎性细胞因子IL-10产生增加,促炎性细胞因子如肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ、IL-12产生减少[36]。1, 25-OH2-D可以促进CD4+T调控Th1/Th2免疫偏移,1, 25-OH2-D/ VDR/RXR复合物可与人IFN-γ启动子中的沉默子区结合,抑制Th1细胞中的促炎细胞因子IFN-γ产生,减缓机体的炎症反应[37]。
综上所述,维生素D具有重要的免疫调节功能,维生素D营养状况不佳是儿童多种感染性疾病的风险因素,因此,维持良好的维生素D营养状况对儿童感染性疾病的预防非常重要。
| [1] |
Föcker M, Antel J, Ring S, et al. Vitamin D and mental health in children and adolescents[J]. Eur Child Adolesc Psychiatry, 2017, 26(9): 1043-1066. DOI:10.1007/s00787-017-0949-3 |
| [2] |
Bae YJ, Kratzsch J. Vitamin D and calcium in the human breast milk[J]. Best Pract Res Clin Endocrinol Metab, 2018, 32(1): 39-45. DOI:10.1016/j.beem.2018.01.007 |
| [3] |
李萌, 梁雪松. 伊可新与鱼肝油丸治疗佝偻病的临床疗效评价[J]. 中国初级卫生保健, 2007, 21(6): 82. |
| [4] |
Lehmann B, Meurer M. Vitamin D metabolism[J]. Dermatol Ther, 2010, 23(1): 2-12. DOI:10.1111/j.1529-8019.2009.01286.x |
| [5] |
李水军. 维生素D代谢及25-羟基维生素D测定方法研究进展[J]. 国际检验医学杂志, 2012, 33(24): 3028-3030. |
| [6] |
Munns CF, Shaw N, Kiely M, et al. Global consensus recommendations on prevention and management of nutritional rickets[J]. Horm Res Paediatr, 2016, 85(2): 83-106. DOI:10.1159/000443136 |
| [7] |
Grad R. Cod and the consumptive:a brief history of cod-liver oil in the treatment of pulmonary tuberculosis[J]. Pharm Hist, 2004, 46(3): 106-120. |
| [8] |
Science M, Maguire JL, Russell ML, et al. Low serum 25-hydroxyvitamin D level and risk of upper respiratory tract infection in children and adolescents[J]. Clin Infect Dis, 2013, 57(3): 392-397. DOI:10.1093/cid/cit289 |
| [9] |
Berry DJ, Hesketh K, Power C, et al. Vitamin D status has a linear association with seasonal infections and lung function in British adults[J]. Br J Nutr, 2011, 106(9): 1433-1440. DOI:10.1017/S0007114511001991 |
| [10] |
Thornton KA, Marín C, Mora-Plazas M, et al. Vitamin D deficiency associated with increased incidence of gastrointestinal and ear infections in school-age children[J]. Pediatr Infect Dis J, 2013, 32(6): 585-593. DOI:10.1097/INF.0b013e3182868989 |
| [11] |
Zhou W, Mao S, Wu L, et al. Association between vitamin D status and sepsis[J]. Clin Lab, 2018, 64(4): 451-460. |
| [12] |
Gamal TS, Madiha AS, Hanan MK, et al. Neonatal and maternal 25-OH vitamin D serum levels in neonates with early-onset sepsis[J]. Children (Basel), 2017, 4(5): 37. |
| [13] |
Cayir A, Turan MI, Ozkan O, et al. Serum vitamin D levels in children with recurrent otitis media[J]. Eur Arch Otorhinolaryngol, 2014, 271(4): 689-693. DOI:10.1007/s00405-013-2455-7 |
| [14] |
Marchisio P, Consonni D, Baggi E, et al. Vitamin D supplementation reduces the risk of acute otitis media in otitis-prone children[J]. Pediatr Infect Dis J, 2013, 32(10): 1055-1060. DOI:10.1097/INF.0b013e31829be0b0 |
| [15] |
Li W, Cheng X, Guo L, et al. Association between serum 25-hydroxyvitamin D concentration and pulmonary infection in children[J]. Medicine (Baltimore), 2018, 97(1): e9060. DOI:10.1097/MD.0000000000009060 |
| [16] |
邓永超, 唐喜春, 黄彩芝, 等. 25(OH)D在重症肺炎患儿中的水平及相关性研究[J]. 国际检验医学杂志, 2017, 38(2): 221-223. |
| [17] |
Wayse V, Yousafzai A, Mogale K, et al. Association of subclinical vitamin D deficiency with severe acute lower respiratory infection in Indian children under 5 y[J]. Eur J Clin Nutr, 2004, 58(4): 563-567. DOI:10.1038/sj.ejcn.1601845 |
| [18] |
Karatekin G, Kaya A, Salihoǧlu O, et al. Association of subclinical vitamin D deficiency in newborns with acute lower respiratory infection and their mothers[J]. Eur J Clin Nutr, 2009, 63(4): 473-477. DOI:10.1038/sj.ejcn.1602960 |
| [19] |
Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns[J]. J Matern Fetal Neonatal Med, 2016, 29(6): 928-932. DOI:10.3109/14767058.2015.1023710 |
| [20] |
Onwuneme C, Carroll A, Doherty D, et al. Inadequate vitamin D levels are associated with culture positive sepsis and poor outcomes in paediatric intensive care[J]. Acta Paediatr, 2015, 104(10): e433-e438. DOI:10.1111/apa.13090 |
| [21] |
李红日, 李伟, 郭琳瑛, 等. 血流感染儿童维生素D营养状况的评价[J]. 中国当代儿科杂志, 2016, 18(3): 215-218. |
| [22] |
Ponnarmeni S, Kumar Angurana S, Singhi S, et al. Vitamin D deficiency in critically ill children with sepsis[J]. Paediatr Int Child Health, 2016, 36(1): 15-21. DOI:10.1179/2046905515Y.0000000042 |
| [23] |
Cizmeci MN, Kanburoglu MK, Akelma AZ, et al. Cord-blood 25-hydroxyvitamin D levels and risk of early-onset neonatal sepsis:a case-control study from a tertiary care center in Turkey[J]. Eur J Pediatr, 2015, 174(6): 809-815. DOI:10.1007/s00431-014-2469-1 |
| [24] |
杨玲蓉, 李桦, 杨涛义, 等. 维生素D缺乏与新生儿早发型败血症的相关性研究[J]. 中国当代儿科杂志, 2016, 18(9): 791-795. |
| [25] |
Aydemir G, Cekmez F, Kalkan G, et al. High serum 25-hydroxyvitamin D levels are associated with pediatric sepsis[J]. Tohoku J Exp Med, 2014, 234(4): 295-298. DOI:10.1620/tjem.234.295 |
| [26] |
Cetinkaya M, Cekmez F, Buyukkale G, et al. Lower vitamin D levels are associated with increased risk of early-onset neonatal sepsis in term infants[J]. J Perinatol, 2015, 35(1): 39-45. DOI:10.1038/jp.2014.146 |
| [27] |
Masten AR. Sunlight in tuberculosis[J]. Dis Chest, 1935, 1(7): 8-10, 22-23. DOI:10.1378/chest.1.7.8 |
| [28] |
Camargo CA Jr, Ganmaa D, Frazier AL, et al. Randomized trial of vitamin D supplementation and risk of acute respiratory infection in Mongolia[J]. Pediatrics, 2012, 130(3): e561-e567. DOI:10.1542/peds.2011-3029 |
| [29] |
Xiao L, Xing C, Yang Z, et al. Vitamin D supplementation for the prevention of childhood acute respiratory infections:a systematic review of randomised controlled trials[J]. Br J Nutr, 2015, 114(7): 1026-1034. DOI:10.1017/S000711451500207X |
| [30] |
Urashima M, Segawa T, Okazaki M, et al. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren[J]. Am J Clin Nutr, 2010, 91(5): 1255-1260. DOI:10.3945/ajcn.2009.29094 |
| [31] |
Hagag AA, El Frargy MS, Houdeeb HA. Therapeutic value of vitamin D as an adjuvant therapy in neonates with sepsis[J]. Infect Disord Drug Targets, 2019, 19: 1-9. DOI:10.2174/187152651901190204152326 |
| [32] |
White JH. Vitamin D metabolism and signaling in the immune system[J]. Rev Endocr Metab Disord, 2012, 13(1): 21-29. DOI:10.1007/s11154-011-9195-z |
| [33] |
莫丽亚, 邓永超. 维生素D缺乏与儿童感染性疾病[J]. 中华检验医学杂志, 2015, 38(4): 226-228. |
| [34] |
张晓丹, 赵贝, 李光慧, 等. 维生素D缺乏与感染发生的相关性及其机制研究进展[J]. 中国药房, 2018, 29(5): 710-715. |
| [35] |
Gombart AF, Borregaard N, Koeffler HP. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1, 25-dihydroxyvitamin D3[J]. FASEB J, 2005, 19(9): 1067-1077. DOI:10.1096/fj.04-3284com |
| [36] |
Barragan M, Good M, Kolls JK. Regulation of dendritic cell function by vitamin D[J]. Nutrients, 2015, 7(9): 8127-8151. DOI:10.3390/nu7095383 |
| [37] |
Colotta F, Jansson B, Bonelli F. Modulation of inflammatory and immune responses by vitamin D[J]. J Autoimmun, 2017, 85: 78-97. DOI:10.1016/j.jaut.2017.07.007 |



