2. 苏州大学附属第一医院纪委, 江苏 苏州 215008;;
3. 山东新华医疗器械股份有限公司研发部, 山东 淄博 255300
2. Commission for Inspecting Discipline, The First Affiliated Hospital of Soochow University, Suzhou 215008, China;;
3. Research and Development Department, Shandong Shinva Medical Instrument Co., Ltd., Zibo 255300, China
医疗机构内重复使用的诊疗器械、器皿和器具应遵循中华人民共和国卫生行业标准(WS310.1-2016)的要求进行清洗、消毒和灭菌[1]。清洗是指通过设备和清洗剂的协同作用去除医疗器械表面污染物,降低微生物负载量的过程。彻底的清洗是医疗器械消毒灭菌成功的前提和关键,而对医疗器械进行彻底的清洗则是一个多因素的综合过程。科学合理的清洗流程、合适的清洗设备和清洗方式,以及去污能力强的医用清洗剂等都是彻底清洗的主要影响因素[2-4]。
近十年,采用超声波清洗医疗器械已经作为新的方法,在医院消毒供应中心(CSSD)广泛应用。部分医疗器械由于有细长管腔、盲孔、狭窄缝隙、半封闭关节等复杂结构,采用常规的手工清洗方法和喷淋清洗方法均难以达到清洗合格的效果[5-9]。研究[10-15]表明,使用后的医疗器械表面及管腔内壁常残留血液、体液、组织物等,如果不能彻底去除这些残留物质,将直接影响医疗器械清洗、消毒和灭菌效果。虽然超声波清洗医疗器械已经在医疗机构应用较普遍,但在实际应用过程中,由于超声波清洗的原理及特性,清洗效果受到诸多因素的影响[16-17]。目前,超声波脱气处理、器械装载方式、最佳清洗温度及医用清洗剂的选择等对超声清洗效果的影响相关研究仍相对较少。本研究拟分析影响医疗器械超声清洗效果的因素,为合理改进医院CSSD超声清洗流程提供参考依据。
1 材料与方法 1.1 试验器材超声波清洗设备购自新华医疗器械股份有限公司,超声波声强检测仪购自北京程成伟业科技有限公司,超声波能量检测瓶(SonoCheckTM)购自上海红柚医疗器械有限公司,管腔型清洗效果检测卡购自GETINGE GROUP,管腔型清洗效果检测装置购自GETINGE GROUP。含酶清洗剂4种,包括国外品牌3种,国内品牌1种。手术器械篮筐标准:篮筐460 mm×275 mm×125 mm,网格14 mm×14 mm,筐底距离舱底为20 mm;外科手术器械包括血管钳、镊子,以及其他普通外科手术器械各100把,均为已清洗消毒后的器械。
1.2 方法超声清洗设备注液40 L(纯水未加热,37℃),器械篮筐空载进行测试,每种检测方法的测试位点的数据均为重复测试5次的平均值。
1.2.1 超声波能量测试瓶检测清洗效果超声波的清洗效果是基于空穴作用,超声能量测试瓶(SonoCheckTM)中的核子会因空穴作用而发生震动,从而使测试瓶中的检测液发生颜色变化,颜色变化程度代表了超声能量的高低。超声波能量瓶通过颜色变化程度判断清洗效果。将SonoCheckTM放置于超声清洗设备中,保证水位情况下开启程序,程序结束后瓶内液体变为黄色即为清洗合格。规定时间内液体颜色的变化程度和液体变为黄色的时间作为评估超声波清洗效果的数据。
1.2.2 管腔型清洗效果监测卡测试清洗效果管腔型清洗效果检测卡主要通过印刷的方式将模拟污染物黏附于不锈钢的金属载体上。模拟污染物由蛋白质、脂肪、多糖以及其他填料组成,充分模拟了医疗器械上常见的有机污染物,而不锈钢载体则真实模拟器械的材质。取管腔型清洗效果检测卡放置于管腔装置中,如果测试中需要灌流则连接设备上的灌流胶管,如果不需要灌流则直接将放卡后的装置放在测试的位置,并保证清洗用水充满整个管腔。经过规定的清洗过程后,取出检测卡,记录模拟污染物被清洗合格的时间作为评估超声波测试结果的指标。
1.2.3 超声波声强检测仪检测清洗能量声强测试仪将测得的声压(P)转换为电压(V),再对电压信号进行有效值转换处理,从而得到电压与声压的对应关系,通过对电压和声压灵敏度进行校准,可以准确得到声强强度。将超声波声强检测仪探头放置于测试位点上,声强强度代表了测试位点的超声能量,同时也可测得超声频率,记录声强和频率作为测试结果,记录测试周期内测试结果的平均值作为评估指标。
1.2.4 不同品牌清洗剂对清洗效果影响的检测将4种品牌的清洗剂分别设置为A、B、C、D组,按照相同的稀释比例(1∶300)进行稀释,每组采用相同的器械篮筐和装载方式,每一组均采用超声波能量瓶检测、清洗效果检测卡检测和超声波声强检测三种方法评估清洗效果。
1.2.5 清洗剂量对清洗效果影响的检测选择进口品牌清洗剂A作为试验用清洗剂,清洗剂量分别设1∶100、1∶200、1∶300、1∶400、1∶500和1∶600共6组,每组采用清洗效果检测卡检测不同清洗剂量的清洗效果。
1.2.6 清洗温度对清洗效果影响的检测选择进口品牌清洗剂A作为试验用清洗剂,由于超声过程中水温会上升,所以探究清洗温度对超声清洗效果的影响,试验变量为清洗用水的初始温度,分别设置25、35、45、55,65℃ 5个试验组,每组采用清洗效果检测卡检测清洗效果。
1.2.7 超声对清洗剂酶活力影响的检测选择进口品牌清洗剂A(多酶清洗剂)为试验用清洗剂,向500 mL烧杯中加入200 mL的清洗剂,将烧杯放入超声设备中进行低频超声,每隔半小时取清洗剂原样10 mL进行酶活力测试,共计采样4次,试验至2 h结束。
1.2.8 蛋白酶酶活力检测蛋白酶在一定温度与 pH 条件下水解酪素底物,再加入三氯乙酸终止反应并除去未水解的酪素。滤液对紫外线有吸收,采用紫外线分光光度法进行测定,根据紫外线吸收度计算酶活力。在一定的条件下,每分钟水解酪蛋白生成 1 μg 酪氨酸所需的酶为 1 个酶活力单位(U)。
称取0.3 g试样置于研钵中, 加入少量的硼酸缓冲溶液,用缓冲溶液定容至一定刻度,充分摇匀配制成试样溶液,稀释该溶液吸光度值在0.25~0.40范围内供测试用(60 min内使用)。吸取试样溶液2 mL置于10 mL比色管中,于40℃水浴保温2 min,加入在40℃水浴中预热的酪蛋白溶液2 mL,然后置于40℃水浴中反应10 min,加入三氯乙酸溶液4 mL摇匀,取出放置10 min,过滤后在波长为275 nm处用10 min比色皿测出滤液的吸光度,做3个平行样,取3个吸光度的平均值A1作为试样溶液测试的吸光度。
空白试验:吸取试样溶液2 mL置于10 mL具塞比色皿中,于40℃水浴保温2 min,加入在40℃水浴中预热的三氯乙酸溶液4 mL,摇匀,反应10 min,加入酪蛋白溶液2 mL,摇匀,取出放置10 min过滤,在波长为275 nm处用10 mm比色皿测出滤液的吸光度。
配制L-酪氨酸标准溶液于比色管中(具体配制方案见表 1),用10 mm比色皿于波长275 nm比色,以不含酪氨酸的0管为空白,分别测定其吸光度,以吸光度A为纵坐标,酪氨酸的浓度ρ为横坐标,绘制标准曲线。根据作图或者回归方程,计算出当吸光度为1时的酪氨酸的量(μg),即为吸光常数K值(其值应在130~135范围内)。
| 表 1 L-酪氨酸标准溶液配制表 Table 1 Preparation table of L-tyrosine standard solution |

|
试样酶活力X1(U/g)计算公式:X1=A1·k·V2·n·f/V1·m1×10。
A1代表试样溶液的平均吸光度;k代表吸光常数;V2代表反应试剂的总体积,单位为毫升,数值为8;n代表试样溶液的稀释倍数;f代表换算系数,为0.50。V1代表吸取试样溶液的体积,单位为毫升,数值为2;m1 代表称取试样的质量,单位为g。反应时间,单位为min。
1.3 统计学分析应用SPSS 22.0版本的统计学软件处理得到的全部数据,组间比较行t检验、σ检验,P≤0.05为差异存在统计学意义。
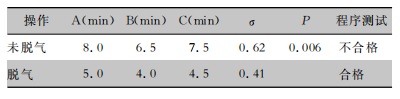
2 结果 2.1 脱气操作对于超声清洗效果的影响 2.1.1 超声波能量瓶检测结果从左到右的三个平行位置(ABC)检测器械篮筐中医疗器械的超声清洗效果,结果显示脱气条件下能量瓶完全变色的时间为4~5 min,未脱气条件下能量瓶完全变色的时间为6~8 min,两组数据差异有统计学意义(P<0.01)。清洗设备将低频超声3 min、高频超声2 min作为一个超声清洗周期,脱气条件下能量瓶检测合格,未脱气条件下检测不合格,结果见表 2。
| 表 2 能量瓶检测脱气对清洗效果的影响 Table 2 Effect of degassing on cleaning efficiency detected by energy bottles |
|
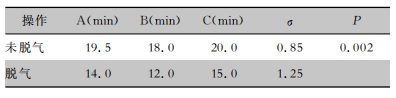
从左到右的三个平行位置(ABC)检测器械篮筐中器械的超声清洗效果,结果显示脱气条件下,清洗效果检测卡清洗至无可视污染物残留的时间为12~15 min;未脱气条件下,清洗效果检测卡清洗至无可视污染物残留的时间为18~20 min,脱气对清洗效果有影响(P<0.01),具体结果见表 3。
| 表 3 清洗效果检测卡检测脱气对超声清洗效果的影响 Table 3 Effect of degassing on ultrasonic cleaning efficiency detected by cleaning effect detection cards |
|
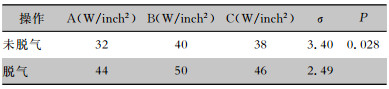
从左到右的三个平行位置(A、B、C)检测器械篮筐中器械的声强能量,结果显示脱气条件下声强数值为44~50 W/inch2,未脱气条件下声强数值为32~40 W/inch2,脱气对相同超声位点的声强能量有影响(P<0.05),结果见表 4。
| 表 4 超声波声强检测仪测试脱气操作对超声声强能量的影响 Table 4 Effect of degassing operation on ultrasonic intensity energy detected by ultrasonic intensity detector |
|
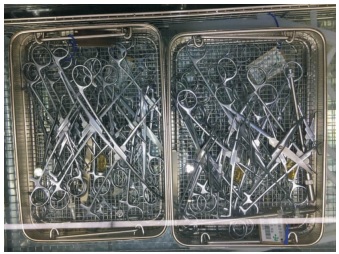
器械的装载方式分为两组(具体摆放见图 1和图 2)。取20把血管钳分别进行规则摆放和堆叠摆放,器械的装载量分为四组:单层单筐、单层双筐、双层单筐、双层双筐。
 |
| 图 1 器械篮筐单层单筐的摆放示意图 Figure 1 Schematic diagram of single-layer and single basket placement of device baskets |
 |
| 图 2 器械篮筐双层双筐的摆放示意图 Figure 2 Schematic diagram of double-layer and double basket placement of device baskets |
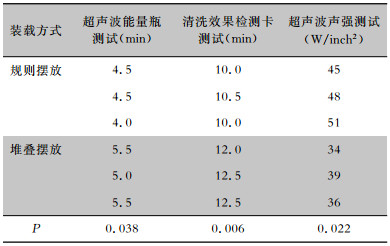
规则摆放组经超声能量瓶测试、清洗效果检测卡测试以及超声波声强测试清洗效果均较堆叠摆放组好(P<0.05),两组间差异有统计学意义,见表 5。
| 表 5 不同装载方式的检测数据比较 Table 5 Comparison in detection data of different loading modes |
|
超声波能量瓶检测显示单层单筐和单层双筐均在4.5 min能变色合格,双层单筐和双层双筐底层的能量瓶在5.0 min内变色合格。清洗效果检测卡检测显示单层单筐和单层双筐清洗至检测卡表面无可视污染物的时间均在10 min,两试验组在相同测试位点无可视差别;双层单筐和双层双筐底层检测清洗至无可视污染物的时间底层篮筐为11.5 min,两试验组在相同的位点无可视差别(P>0.05)。超声波声强检测显示单层单筐和单层双筐在相同位点声强为45~46 W/inch2,双层单筐和双层双筐检测的声强分别为36 W/inch2和35 W/inch2。见表 6。
| 表 6 不同装载量的检测数据比较 Table 6 Comparison in detection data of different loading capacity |

|
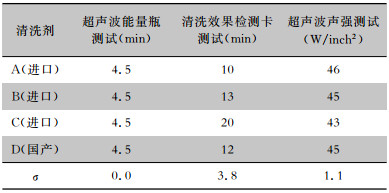
在相同的稀释比例下,不同品牌的清洗剂超声波能量瓶和超声波声强测试结果基本无差别;清洗效果检测卡测试结果差异很大,清洗剂A合格时间为10 min,而清洗剂C合格时间为20 min,σ为3.8表明数据离散程度较高。见表 7。
| 表 7 不同品牌清洗剂对超声清洗效果的检测数据比较 Table 7 Comparison in detection data of effect of different brands of detergent on ultrasonic cleaning efficiency |
|
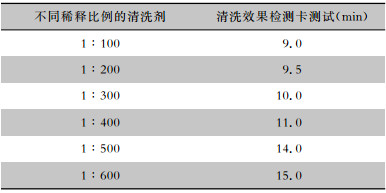
清洗剂的加入量越大清洗至检测卡表面无可视污染物的时间越短,即清洗速度越快。见表 8。
| 表 8 清洗剂量对清洗效果的检测数据比较 Table 8 Comparison in detection data of effect of cleaning dosage on cleaning efficiency |
|
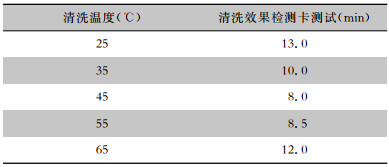
研究结果显示,低于45℃时清洗速度(检测卡表面清洗至无可视污染物的时间)随温度上升而提高,超过45℃后升温对清洗速度基本无影响,超过55℃后反而清洗速度下降。见表 9。
| 表 9 清洗温度对超声清洗效果的检测数据比较 Table 9 Comparison in detection data of effect of cleaning temperature on ultrasonic cleaning efficiency |
|
经酶活力测试结果显示,超声对于清洗剂原液的酶活力基本无影响(P>0.05),各测试点的蛋白酶酶活力均值与检验值之间差异无统计学意义(P>0.05)。见表 10。
| 表 10 超声对于清洗剂酶活力的影响检测数据 Table 10 Detection data of effect of ultrasound on enzyme activity of detergent |

|
超声波清洗医疗器械是利用超声波在液体中的加速作用、空化作用及直流作用对液体、污物进行冲击,使污物被分散、润湿以及被剥离的过程[18-20]。超声波清洗效果受许多因素影响,包括脱气、器械摆放、清洗剂的种类和加注量、清洗温度以及酶活力等[21-22]。
本研究结果显示,脱气操作可提高超声波清洗效能。通过超声波能量瓶的检测,在未脱气的条件下能量瓶完全变色的时间要比脱气条件下的时间慢2.5~3 min;通过超声波声强的检测,相同测试位点的声强能量值脱气组较未脱气组低8~12 W/inch2。从清洗效果检测卡的结果来看,清洗卡表面模拟污染物清洗至无可视污染物的时间,脱气条件下比未脱气的要快6 min左右。研究中发现清洗水中的微气泡会影响超声能量的传播,因此,彻底的脱气才能保证超声能量在各个位点均匀分布,达到良好的清洗效果。
本研究显示,采用同样的检测条件分析医疗器械的摆放、装载方式,发现单层规则的摆放要比堆叠摆放超声清洗效果好。由于测试设备的超声波换能器位于底部,能量由下向上传播,所以堆叠摆放对于上层器械的清洗很不利。研究显示,单层单筐和单层双筐都能达到很好的清洗效果,单层的装载方式无论是单筐还是双筐均不影响超声能量的传播。双层单筐和双层双筐上下层器械筐的清洗效果差异有统计学意义。通过能量瓶检测显示,上层器械清洗合格慢0.5 min;清洗效果检测卡检测显示上层慢1.5 min,且超声波声强能量值上层要低10 W/inch2左右。本研究设备换能器位于底部,器械的摆放可以影响超声能量向上均匀传播,器械距离换能器越远则清洗效果越差。换能器位于底部的设备,竖直方向可以影响超声能量的均匀传播;换能器位于侧边的设备,超声能量在空间上分布比较均匀,规则摆放显得尤为重要。
本研究显示清洗剂的清洗效果受清洗剂的种类、加注量、清洗温度以及酶活力的稳定等因素的影响。清洗剂在超声清洗的过程中起到辅助作用,超声能够通过物理作用清除污物,而清洗剂在此过程中能够对污染物起到润湿、剥离、分解的作用,尤其是清洗剂中的生物酶制剂能够彻底的分解污物,有效防止污染物的再次黏附,对于彻底清洗意义重大[23-24]。根据国标福林法的测试方法,不同时间长度超声对清洗剂进行酶活力测试,发现短时间的超声并不会影响蛋白酶的活力[25]。研究发现不同品牌的清洗剂清洗效果差别很大,同一品牌清洗剂的加注量越大清洗效果越好;一定范围内温度越高清洗效果越好,清洗剂中的活性物质的作用温度有一个合适的区间,低于这个区间会影响清洗剂对污染物的剥离,而高于这个区间会影响酶的活性或造成表面活性剂的析出,从而影响清洗效果。在实际工作中,需选择合适的医用清洗剂、合理的清洗剂量和清洗温度才能配合超声清洗设备达到良好的清洗效果。
综上所述,随着医疗器械的不断发展,超声波清洗医疗器械的方式方法也在不断改进和优化。为了使超声清洗设备达到较好的效果,需对设备进行彻底的脱气,对器械进行规则摆放、合理的装载,同时选择高效的医用清洗剂、合理的清洗剂加注量和最佳的清洗温度。
| [1] |
中华人民共和国国家卫生和计划生育委员会. 医院消毒供应中心第1部分:管理规范:WS 310.1-2016[S]. 北京:中国标准出版社, 2016.
|
| [2] |
Aoyagi K. Method for cleaning and sterilizing medical equipment after use:United States, 6858181[P]. 2005-02-22.
|
| [3] |
Peterson WC. Ultrasonic cleaner and surgical instrument case:United States, 3640295[P]. 1972-02-08.
|
| [4] |
徐惠莲, 邵文博, 张惠民. 多酶清洗剂对器械清洗效果的观察[J]. 中华医院感染学杂志, 2009, 19(10): 1238-1239. |
| [5] |
World Health Organization. Practical guidelines for infection control in health care facilities[J]. Geneva:WHO Library Cataloguing, 2004. |
| [6] |
丁兆梅, 余艳琼, 黄蓉, 等. 手术室器械隔夜清洗的管理研究[J]. 中华医院感染学杂志, 2014, 24(13): 3368-3369, 3372. |
| [7] |
郭海燕, 曹力, 张芳, 等. 消毒供应科再生医疗器械清洗质量的影响因素及对策[J]. 中华医院感染学杂志, 2012, 22(13): 2801. |
| [8] |
徐萍, 王晓娅, 吕健, 等. 影响手术器械清洗质量的因素及对策[J]. 中国消毒学杂志, 2011, 28(4): 487. |
| [9] |
苑世英, 徐美玲. 医院消毒供应室医疗器械清洗质量调查[J]. 中国消毒学杂志, 2011, 28(1): 62-64. |
| [10] | |
| [11] |
Veiga-Malta I. Preventing healthcare-associated infections by monitoring the cleanliness of medical devices and other critical points in a sterilization service[J]. Biomed Instrum Technol, 2016, 50(Suppl 3): 45-52. |
| [12] |
Basu D, Bhattacharya S, Mahajan A, et al. The importance of the central sterile supply department in infection prevention and control[J]. Infect Control Hosp Epidemiol, 2014, 35(10): 1312-1314. DOI:10.1086/678072 |
| [13] |
张艳芳, 王霞, 周红哲, 等. 3种方法检测手术器械清洗效果的比较[J]. 中华医院感染学杂志, 2013, 23(16): 4016-4017, 4020. |
| [14] |
林娟, 孔春霞, 周小丹, 等. 鲁沃夫生物膜清洗剂对手术器械清洗效果观察[J]. 中华医院感染学杂志, 2012, 22(12): 2627. |
| [15] |
任伟. 不同清洗剂及其不同作用时间对内镜生物膜清除的实验研究[D]. 广州:南方医科大学, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Y1997511
|
| [16] |
丁淑贞, 李晓艳, 戴红, 等. 多酶清洗液在手工清洗医疗器械中的有效应用[J]. 中华医院感染学杂志, 2010, 20(4): 519-520. |
| [17] |
索继江, 蒋礼恒, 魏华, 等. 医疗器械酶洗应注意的问题[J]. 中华医院感染学杂志, 2006, 16(9): 1027-1029. |
| [18] |
冀红宙. 超声波清洗的原理研究及实现[J]. 企业技术开发(下半月), 2014(17): 3-5. |
| [19] |
苏卫军. 超声波清洗技术发展及应用[J]. 军民两用技术与产品, 2015(18): 41. |
| [20] |
刘玲, 甘俊丽, 张世华, 等. 超声波清洗机清洗效果监测方法及影响因素[J]. 中国消毒学杂志, 2016, 33(6): 603-604. |
| [21] |
康永, 郑莉, 邵世权. 超声波清洗技术研究进展[J]. 清洗世界, 2012, 28(4): 12-16. |
| [22] |
倪杰雄. 新华QX2000超声清洗机原理与故障维修实例分析[J]. 机电信息, 2016(30): 55, 57. |
| [23] |
Geret L, Stingl C, Denzin S. Multiple enzyme cleaner for surgical instruments and endoscopes:United States, 7670549[P]. 2010-03-02.
|
| [24] |
田桂登, 田雍, 侯秋华, 等. 常规医疗器械不同清洗方法对比研究[J]. 中华医院感染学杂志, 2009, 19(17): 2300-2301. |
| [25] |
唐文慧, 张淑北, 杨燕, 等. 复用医疗器械在消毒供应室清洗的重要性[J]. 中华医院感染学杂志, 2009, 19(18): 2444-2445. |



