2. 河南科技大学医学技术与工程学院, 河南 洛阳 471003;
2. College of Medical Technology and Engineering, Henan University of Science and Technology, Luoyang 471003, China;;
3. 河南科技大学动物科技学院, 河南 洛阳 471003
碳青霉烯类抗生素是治疗临床革兰阴性杆菌感染的最后一道防线。耐碳青霉烯类革兰阴性菌的产生及全球性的播散,使得临床抗感染药物的选择面临巨大的挑战[1]。碳青霉烯类抗生素耐药的主要原因是产碳青霉烯酶水解相应抗生素,最主要的碳青霉烯酶有五大类[2],包括KPC、NDM、IMP、VIM和OXA-48,其中最常见的是由blaKPC同位基因编码的A类丝氨酸类酶KPC(Klebsiella pneumoniae carbapenemase)[3]。2003年美国YIGITH等在一株耐碳青霉烯类肺炎克雷伯菌(carbapenemas-resistant Klebsiella pneumoniae,CRKP)中首次发现了blaKPC基因[4],并将其归类于A类丝氨酸水解酶,命名为KPC-1。2003年YIGITH等[5]在一株臭鼻克雷伯耐药菌株上发现了第二个blaKPC(blaKPC-2)基因,与blaKPC-1相比,在编码区520 bp处发生点突变,表现出单个氨基酸的改变(S174G)。随后世界各地相继发现了blaKPC的其他亚型,目前已知blaKPC至少存在18种亚型,共有20个位点的碱基突变(13个氨基酸改变),其中只有1个变异体有6个碱基缺失(KPC-14,核苷酸位置:722~727 bp),其他基因亚型之间均表现在单个碱基的突变[6-7],KPC-2和KPC-3是世界范围内广泛传播的碳青霉烯酶。
为减少耐药菌株的水平传播,临床须对携带该类菌株的患者进行单独管理[8]。然而目前,发展中国家绝大多数医院缺乏相应的强化感染控制措施(intensive infection control measures ICMs)。对于碳青霉烯耐药的检测只是局限在表型耐药,并未深入分析耐药的分子机制及其传播规律。中国各地报道的耐碳青霉烯类革兰阴性杆菌的临床耐药性及碳青霉烯酶的分布表现出地域差异[9-12]。本研究基于河南科技大学第一附属医院两个院区2017年1月—2018年12月获得的临床分离株,分析碳青霉烯耐药菌株临床分布特点,重点追踪blaKPC基因及其亚型流行规律,为临床对碳青霉烯类耐药菌株的综合防控提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 菌株来源2017年1月—2018年12月河南科技大学第一附属医院两个院区临床送检的各种标本检出的耐碳青霉烯类革兰阴性杆菌。耐碳青霉烯类革兰阴性杆菌的判断标准严格遵守美国疾病控制与预防中心的最新定义[13],细菌对亚胺培南、美罗培南或厄他培南中至少一种耐药,耐药判断依据为2017版临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)指南[14],肠杆菌科细菌耐药最低抑菌浓度(MIC)值:亚胺培南≥4 μg/mL和(或)美罗培南≥4 μg/mL和(或)厄他培南≥2 μg/mL;非肠杆菌科细菌中铜绿假单胞菌和不动杆菌属对亚胺培南或美罗培南至少一种抗菌药物耐药(亚胺培南≥8 μg/mL和(或)美罗培南≥8 μg/mL);其他非肠杆菌科细菌对亚胺培南或美罗培南中至少一种耐药(亚胺培南≥16 μg/mL和(或)美罗培南≥16 μg/mL)。质控菌株购于卫生部临床检验中心:肺炎克雷伯菌ATCC 700603、铜绿假单胞菌ATCC 27853。
1.1.2 主要仪器及试剂Micoscan Walkaway 960(德国西门子)、VITEK 2 Compact全自动细菌药敏分析仪(法国生物梅里埃)、PCR 扩增仪(杭州博日公司) 、电泳仪(珠海黑马公司)、凝胶成像仪(上海欧翔科学仪器有限公司)、PCR反应试剂盒、扩增引物、mix及DNA marker[生工生物工程(上海)有限公司]、血平板和中国蓝平板(安图生物有限公司)、低电渗琼脂糖(徐州微科曼得公司)。
1.2 试验方法 1.2.1 菌株培养鉴定及药物敏感试验按照《全国临床检验操作规程》第4版进行常规细菌培养、分离。采用Micoscan Walkaway 960和VITEK 2 Compact全自动微生物鉴定及药敏分析仪进行菌株鉴定及药敏试验。药物敏感试验结果判定依据CLSI 2017年标准[14]。
1.2.2 DNA模板制备无菌采集分离株,取适量接种于血平板上,37℃培养24 h。挑选3~5个单个菌落置于200 μL的无菌ddH2O中,充分振荡、混匀,置于100℃金属加热器中煮沸15 min,立即冰浴10 min,经15 000 r/min低温离心10 min,取上清,-20℃保存待用。
1.2.3 耐药基因的检测采用聚合酶链反应(PCR)分别对blaKPC、blaNDM、blaIMP、blaVIM和blaOXA-48基因进行扩增。PCR反应体系为:总体积25 μL,其中Master Mix (2×) 12.5 μL,上游引物、下游引物、DNA模版各1 μL,ddH2O 9.5 μL。PCR反应条件为:94℃预变性2 min,94℃变性30 s;55℃退火30 s;72℃模板延伸30 s;共36个循环;72℃延伸10 min。取扩增产物10 μL通过1.5%的琼脂糖凝胶电泳30 min,最终在凝胶成像仪上观察结果。引物序列见表 1,引物合成及PCR产物序列测定由生工生物工程(上海)完成。
| 表 1 耐药基因PCR引物序列及产物长度 Table 1 Primer sequence and product length of PCR of drug resistance genes |
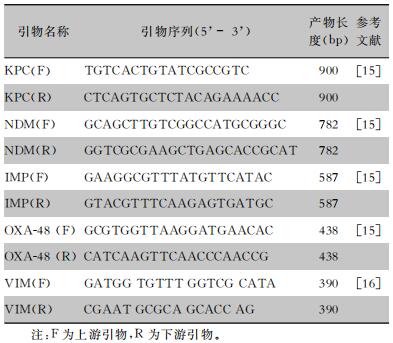
|
2017年1月—2018年12月河南科技大学第一附属医院两个院区送检的各类临床标本中共检出耐碳青霉烯类革兰阴性杆菌510株,其中耐碳青霉烯类肠杆菌科细菌(CRE)420株、非肠杆菌科细菌90株,菌种分布见表 2。耐碳青霉烯类革兰阴性杆菌主要来自重症监护病房(ICU)、神经外科和呼吸科,分别占60.8%、11.8%、5.3%;标本来源主要为痰、脓性分泌物、静脉血、无菌中段尿,分别占66.9%、8.8%、8.2%、6.5%;患者年龄≥50岁者占71.6%;住院日数≥15 d者占79.8%。
| 表 2 510株耐碳青霉烯类革兰阴性杆菌菌种分布 Table 2 Species distribution of 510 strains of carbapenem-resistant Gram-negative bacilli |
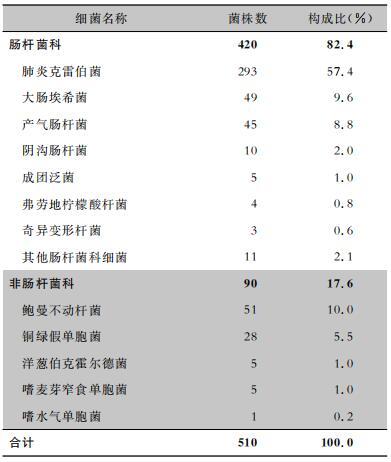
|
420株CRE对亚胺培南、美罗培南、厄他培南的耐药率分别为90.5%、94.0%、98.3%;对氨苄西林的耐药率为100%,对氨曲南、头孢菌素类、氨苄西林/舒巴坦、头霉素类抗生素的耐药率均>90%,对阿米卡星、妥布霉素、复方磺胺甲口恶唑的耐药率略低,分别为69.8%、79.5%、71.4%;对替加环素的耐药率最低,为18.3%。见表 3。
| 表 3 510株耐碳青霉烯类革兰阴性杆菌对常见抗菌药物的耐药情况 Table 3 Resistance of 510 strains of carbapenem-resistant Gram-negative bacilli to commonly used antimicrobial agents |
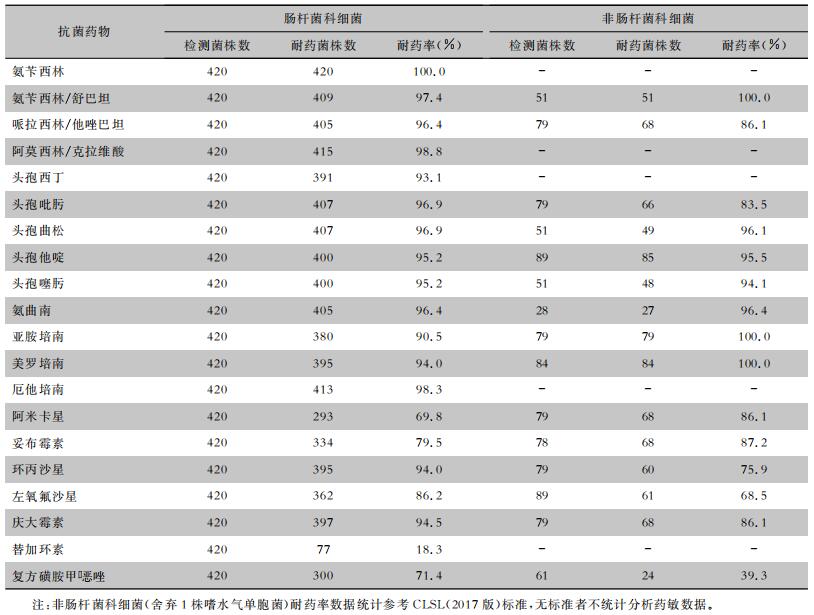
|
420株CRE中,耐药基因检出率56.7%,blaKPC携带率为54.3%。228株携带blaKPC菌株中,肺炎克雷伯菌、产气肠杆菌、大肠埃希菌分别占83.8%(191株)、11.8%(27株)、2.6%(6株);另外在1株阴沟肠杆菌、1株摩根摩根菌、1株弗劳地柠檬酸杆菌、1株住泉沙雷菌中也检出blaKPC基因;blaNDM携带率1.2%(5/420),检出菌为阴沟肠杆菌(2株)、大肠埃希菌(1株)、肺炎克雷伯菌(1株)、鲍曼不动杆菌(1株);blaIMP携带率1.4%(6/420),检出菌为克雷伯菌(4株)、摩氏摩根菌(1株)、阴沟肠杆菌(1株);未发现VIM和OXA-48型耐药基因。90株非发酵菌中,仅2株鲍曼不动杆菌检出携带blaKPC基因,暂未发现其他菌种携带碳青霉烯耐药基因,部分阳性PCR结果见图 1。
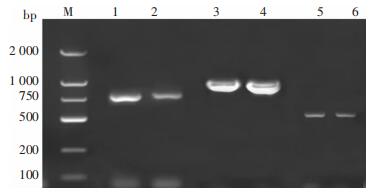 |
| M为DNA Marker,1—2为NDM阳性,3—4为KPC阳性,5—6为IMP阳性。 图 1 耐碳青霉烯类革兰阴性杆菌blaNDM、blaKPC、blaIMP基因PCR扩增产物电泳图 Figure 1 Electrophoresis map of PCR amplification pro-ducts of blaNDM, blaKPC, and blaIMP in carba-penem-resistant Gram-negative bacilli |
对携带blaKPC基因的172株CRE和2株鲍曼不动杆菌进行基因测序比对分析,结果显示173株为KPC-2型菌株,1株为KPC-1型菌株,未发现blaKPC的其他基因亚型。其中blaKPC-1由肺炎克雷伯菌携带,该blaKPC-1基因在blaKPC-2(AY210886)原始DNA序列的520 bp处发生突变,暂未发现其他位点的碱基突变。见图 2。
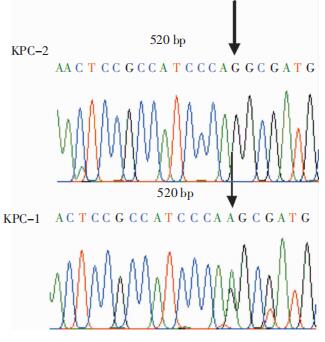 |
| KPC-2与KPC-1在520 bp处有基因G-A的突变。 图 2 KPC-2与KPC-1的DNA序列差异 Figure 2 Difference between KPC-2 and KPC-1 DNA sequence |
碳青霉烯类抗生素是治疗产AmpC酶和超广谱β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)菌株的临床治疗药物,随着该类药物的过渡使用,其耐药范围也从欧洲发达国家发展到中国及非洲的发展中国家[17]。本研究结果显示,该院分离的耐碳青霉烯类革兰阴性杆菌以CRE为主(82.4%),其中肺炎克雷伯菌占CER的69.8%。耐碳青霉烯类革兰阴性杆菌多集中在ICU(60.8%)和神经外科(11.8%),年龄多在50岁及以上(71.6%),与国内研究[18]报道一致。回顾性分析患者的既往史发现,大部分耐药菌感染患者存在严重的原发疾病,如颅脑损伤,严重心脑血管疾病,住院日数大多≥15 d(79.8%),并且长期接受广谱抗菌药物的治疗,说明严重原发疾病、患者的健康状态以及广谱抗菌药物的使用,都是耐碳青霉烯类革兰阴性杆菌的重要危险因素,提示临床应注意合理使用抗菌药物,避免超适应证给药。本研究表明,耐碳青霉烯类革兰阴性杆菌可分离自痰、血、尿、腹腔等,说明耐药菌株引起的感染并不仅局限于呼吸系统和泌尿系统,还能引起血液、腹腔、颅内等多部位感染,其感染的广泛性应引起临床重视。
blaKPC-2通常位于20~200 kb大小不相容的共轭质粒中[19],该质粒不仅能在不同菌种之间水平传播,引起医院CRE的暴发流行[20],而且能同时携带包括ESBLs在内的多种耐药基因,导致携带blaKPC的菌株能同时水解多种抗菌药物[21]。药敏结果显示,420株CRE对青霉素类、氨苄西林/舒巴坦、头孢菌素类、氨曲南、头霉素类抗生素的耐药率均高于90%,与其他文献[18, 22]报道相近,可能与耐碳青霉烯类革兰阴性杆菌感染者长期使用β-内酰胺类抗生素有关,提示临床应当慎重经验用药。对阿米卡星、妥布霉素、复方磺胺甲口恶唑的耐药率略低,分别为69.8%、79.5%、71.4%,临床可选择这些抗菌药物治疗感染者,但值得注意的是,耐碳青霉烯类革兰阴性杆菌对其他常见抗菌药物均耐药,临床可选择的抗菌药物受限,必须根据患者实际耐受情况及药敏试验结果合理使用。目前治疗耐碳青霉烯类革兰阴性杆菌最有效的措施之一是多粘菌素或替加环素联合碳青霉烯类抗生素,随着该治疗方案的普遍应用,已出现联合用药治疗失败的报道[23]。该院替加环素的耐药率为18.3%,高于其他地区的报道[22, 24],可能与CRE的菌种构成比不同有关,或是因为检测方法和菌株收集数量有限对统计结果有一定的影响,将在以后的研究中继续完善。研究[24]表明,在产ESBLs 或 AmpC 酶肠杆菌科菌株中, 厄他培南比亚胺培南及美罗培南有更高的MIC值。本研究虽未对相关数据进行检测,但高产ESBLs或 AmpC 联合膜孔蛋白缺失或低表达导致外膜通透性降低是CRE产酶之外重要的耐药机制[24]。是否可以通过比较碳青霉烯类抗生素的MIC值,进行产碳青霉烯酶的初步判断,还需进一步的试验支持。90株耐碳青霉类非肠杆菌科细菌对临床常用抗菌药物耐药比较严重,除了对复方磺胺甲口恶唑和左氧氟沙星的耐药率分别为39.3%和68.5%外,对大多数抗菌药物的耐药率均大于80%,这说明耐碳青霉烯类非肠杆菌科细菌的临床用药选择非常有限。
我国流行的碳青霉烯酶主要是KPC、NDM和IMP,其中以KPC酶最常见。本研究结果显示,420株CRE中,耐药基因携带率56.7%,其中228株携带blaKPC基因,5株携带blaNDM基因,6株携带blaIMP基因,试验结果以KPC酶为主。blaKPC携带率占前三位的菌株分别为肺炎克雷伯菌、产气肠杆菌和大肠埃希菌,其中肺炎克雷伯菌是携带blaKPC的优势菌群,与中国其他地区[25]报道一致。90株非肠杆菌科细菌碳青霉烯酶携带率为2.2%,且均为KPC酶,这说明非肠杆菌科细菌对碳青霉烯类抗生素的耐药机制或携带的碳青霉烯酶种类有所不同,这将在下一步研究中继续阐明。该研究中,高比例的产气肠杆菌对blaKPC的携带,显示出产KPC酶的本院特征与地域差异,但因本研究尚未覆盖其他少见基因如blaGES、blaIMI等,因此具有一定局限性。本研究数据表明,KPC酶不仅局限于肺炎克雷伯菌、产气肠杆菌、大肠埃希菌等,在阴沟肠杆菌、住泉沙雷菌等菌株中也检测出blaKPC基因的携带。2株鲍曼不动杆菌对blaKPC的携带说明blaKPC不仅局限在CRE中,在不同种属之间也能水平传播。
KPC-2是世界上最广泛流行的碳青霉烯酶。国际流行ST258,而我国最常见的是携带blaKPC-2的ST11型肺炎克雷伯菌[25]。肺炎克雷伯菌具有获得耐药基因,并将其遗传的强大能力,可能是肺炎克雷伯菌成为最主流的携带菌携带blaKPC菌株的原因。基因测序结果表明174株携带blaKPC菌株中,仅1株肺炎克雷伯菌携带blaKPC-1,其他均为KPC-2型菌株,表明该院blaKPC-2占据blaKPC的主导地位。KPC家族有四个突变热点,其中氨基酸残基237位、239位影响酶的活性[26-27]。本研究基因测序结果显示,所有blaKPC-2的碱基序列一致,并未发现编码区非突变热点的其他变异部位,说明blaKPC-2来源单一,推测KPC耐药基因可能有共同的克隆来源。试验结果以携带blaKPC-2的肺炎克雷伯菌为主,与中国其他地区的报道一致[25]。
碳青霉烯类抗生素耐药给患者治疗带来严重压力,病死率极高,是全国乃至全世界所面临的巨大挑战。本研究是单中心研究,涉及的标本量偏少,不能覆盖整个洛阳地区耐碳青霉烯类革兰阴性杆菌的流行情况,单从现有的研究结果来看,本研究是洛阳地区首次报告碳青霉烯类耐药菌株的临床数据,包含了肠杆菌科细菌和非肠杆菌科细菌的表型耐药及分子耐药数据,对临床耐药菌管理、控制及抗菌药物使用有一定指导意义。该地区耐碳青霉烯类革兰阴性杆菌与河南其他地区相比具有相似性,其流行均高于国家水平。碳青霉烯类抗生素耐药机制以产KPC为主,也可见少量金属酶NDM和IMP,且对大多数抗菌药物耐药,因此,对碳青霉烯类耐药菌株的管理应更加严谨,防止其暴发流行。
| [1] |
Logan LK, Weinstein RA. The epidemiology of carbapenem-resistant Enterobacteriaceae:the impact and evolution of a global menace[J]. J Infect Dis, 2017, 215(Suppl 1): S28-S36. |
| [2] |
Nordmann P, Poirel L. The difficult-to-control spread of carbapenemase producers among Enterobacteriaceae worldwide[J]. Clin Microbiol Infect, 2014, 20(9): 821-830. DOI:10.1111/1469-0691.12719 |
| [3] |
Biberg CA, Rodrigues AC, do Carmo SF, et al. KPC-2-producing Klebsiella pneumoniae in a hospital in the Midwest region of Brazil[J]. Braz J Microbiol, 2015, 46(2): 501-504. DOI:10.1590/S1517-838246246220140174 |
| [4] |
Yigit H, Queenan AM, Anderson GJ, et al. Novel carbape-nem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161. DOI:10.1128/AAC.45.4.1151-1161.2001 |
| [5] |
Yigit H, Queenan AM, Rasheed JK, et al. Carbapenem-resistant strain of Klebsiella oxytoca harboring carbapenem-hydrolyzing beta-lactamase KPC-2[J]. Antimicrob Agents Chemother, 2003, 47(12): 3881-3889. DOI:10.1128/AAC.47.12.3881-3889.2003 |
| [6] |
Porreca AM, Sullivan KV, Gallagher JC. The epidemiology, evolution, and treatment of KPC-producing organisms[J]. Curr Infect Dis Rep, 2018, 20(6): 13. DOI:10.1007/s11908-018-0617-x |
| [7] |
Stoesser N, Sheppard AE, Peirano G, et al. Genomic epidemiology of global Klebsiella pneumoniae carbapenemase (KPC)-producing Escherichia coli[J]. Sci Rep, 2017, 7(1): 5917. DOI:10.1038/s41598-017-06256-2 |
| [8] |
Babu Rajendran N, Gladstone BP, Rodríguez-Baño J, et al. Epidemiology and control measures of outbreaks due to antibio-tic-resistant organisms in Europe (EMBARGO):a systematic review protocol[J]. BMJ Open, 2017, 7(1): e013634. |
| [9] |
郑恬, 徐修礼, 陈潇. 肠杆菌科细菌耐药性及其耐碳青霉烯类菌株分布特点[J]. 中国感染控制杂志, 2017, 16(2): 121-125. |
| [10] |
刘周, 徐晨, 管世鹤. 碳青霉烯耐药肠杆菌耐药机制及临床传播特征分析[J]. 中华传染病杂志, 2019, 37(3): 171-173. |
| [11] |
宁长秀, 卢雪兰, 邹文娇, 等. 耐碳青霉烯类鲍曼不动杆菌中碳青霉烯酶基因的检测[J]. 中国抗生素杂志, 2018, 43(7): 901-904. |
| [12] |
曾为伦, 吴海鸥, 章如玲, 等. 多重耐药铜绿假单胞菌的相关耐药机制研究[J]. 中国抗生素杂志, 2016, 41(5): 377-381. |
| [13] |
Centers for Disease Control and Prevention. Facility guidance for control of carbapenem-resistant Enterobacteriaceae bacteria(CRE)[EB/OL]. (2015-11)[2019-09-20] https://www.cdc.gov/hai/pdfs/cre/CRE-guidance-508.pdf.
|
| [14] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing:M100-S27[S]. Pennsylvania:CLSI, 2017.
|
| [15] |
Hosseinzadeh Z, Sedigh Ebrahim-Saraie H, Sarvari J, et al. Emerge of blaNDM-1 and blaOXA-48-like harboring carbape-nem-resistant Klebsiella pneumoniae isolates from hospitalized patients in southwestern Iran[J]. J Chin Med Assoc, 2018, 81(6): 536-540. DOI:10.1016/j.jcma.2017.08.015 |
| [16] |
Poirel L, Walsh TR, Cuvillier V, et al. Multiplex PCR for detection of acquired carbapenemase genes[J]. Diagn Microbiol Infect Dis, 2011, 70(1): 119-123. DOI:10.1016/j.diagmicrobio.2010.12.002 |
| [17] |
Manenzhe RI, Zar HJ, Nicol MP, et al. The spread of carbape-nemase-producing bacteria in Africa:a systematic review[J]. J Antimicrob Chemother, 2015, 70(1): 23-40. DOI:10.1093/jac/dku356 |
| [18] |
Zhang Y, Wang Q, Yin Y, et al. Epidemiology of carbape-nem-resistant Enterobacteriaceae infections:report from the China CRE network[J]. Antimicrob Agents Chemother, 2018, 62(2): e01882-17. |
| [19] |
Miller BM, Johnson SW. Demographic and infection characteristics of patients with carbapenem-resistant Enterobacteria-ceae in a community hospital:development of a bedside clinical score for risk assessment[J]. Am J Infect Control, 2016, 44(2): 134-137. DOI:10.1016/j.ajic.2015.09.006 |
| [20] |
Nordmann P. Carbapenemase-producing Enterobacteriaceae:overview of a major public health challenge[J]. Med Mal Infect, 2014, 44(2): 51-56. DOI:10.1016/j.medmal.2013.11.007 |
| [21] |
Deshpande LM, Rhomberg PR, Sader HS, et al. Emergence of serine carbapenemases (KPC and SME) among clinical strains of Enterobacteriaceae isolated in the United States Medical Centers:report from the MYSTIC program (1999-2005)[J]. Diagn Microbiol Infect Dis, 2006, 56(4): 367-372. DOI:10.1016/j.diagmicrobio.2006.07.004 |
| [22] |
甘龙杰, 陈善建, 林宇岚, 等. 碳青霉烯类耐药肠杆菌科细菌基因型检测及耐药性分析[J]. 临床检验杂志, 2018, 36(9): 663-666. |
| [23] |
Strugeon E, Tilloy V, Ploy MC, et al. The stringent response promotes antibiotic resistance dissemination by regulating integron integrase expression in biofilms[J]. mBio, 2016, 7(4): e00868-16. |
| [24] |
张保荣, 毕茹茹, 孔子艳, 等. 宿迁地区碳青霉烯类耐药肠杆菌科细菌耐药性及碳青霉烯酶基因型分析[J]. 临床检验杂志, 2018, 36(9): 667-671. |
| [25] |
Liu J, Yu J, Chen F, et al. Emergence and establishment of KPC-2-producing ST11 Klebsiella pneumoniae in a general hospital in Shanghai, China[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(2): 293-299. DOI:10.1007/s10096-017-3131-4 |
| [26] |
Papp-Wallace KM, Taracila M, Hornick JM, et al. Substrate selectivity and a novel role in inhibitor discrimination by residue 237 in the KPC-2 beta-lactamase[J]. Antimicrob Agents Chemother, 2010, 54(7): 2867-2877. DOI:10.1128/AAC.00197-10 |
| [27] |
Hidalgo-Grass C, Warburg G, Temper V, et al. KPC-9, a novel carbapenemase from clinical specimens in Israel[J]. Antimicrob Agents Chemother, 2012, 56(11): 6057-6059. DOI:10.1128/AAC.01156-12 |




 唑
唑