新生儿败血症(也称新生儿脓毒症)是指病原菌侵入机体血液循环,并在其中繁殖,产生毒素,所致的全身性感染。新生儿败血症是导致新生儿死亡常见原因,在早产儿及低出生体重儿中更为严重,早产儿自身存在免疫功能障碍,缺乏获得性母体IgG抗体,感染发生率较正常体重新生儿高3~10倍。住院早产儿接受侵入性操作较多、长时间的静脉通路、气管插管和不合理应用抗菌药物等[1],使得早产儿与足月儿相比更易发生医院获得性感染。另外,早产儿心血管发育不成熟,甲状腺功能低下和血流动力学表现复杂且多变,早期识别较困难,疾病发现时即可进展为感染性休克,病死率更高,即使幸存,也会增加终身残疾以及生活质量低下的风险,给家长及社会带来沉重的经济和精神负担[2]。早产儿败血症血培养阳性率不高,早期诊断困难,治疗针对性困难。本研究回顾性研究某院早产儿重症监护病房(NICU)血培养阳性败血症早产儿的临床资料,比较分析革兰阴性(G-)杆菌、革兰阳性(G+)球菌及真菌败血症的特点,以提高对早产儿败血症不同病原菌临床特点的认识,提高早期诊疗水平, 对提高存活率,改善远期预后意义重大。
1 对象与方法 1.1 研究对象2016年1月—2018年12月湖南省儿童医院NICU收治的血培养阳性、实验室确诊早产儿败血症155例,发病率9.76%(155/1 588)。所有早产儿均按照《新生儿败血症诊疗方案》[3]确诊。
1.2 方法查阅病历,收集早产儿相关资料,包括胎龄、性别、分娩方式、出生体重、发病日龄、经外周静脉置入中心静脉导管(peripherally inserted central catheter,PICC)、临床表现、发生败血症时相关实验室指标、转归。根据血培养结果,分为G-菌、G+菌及真菌败血症组,并对相关检测指标进行比较分析。
1.3 统计学方法应用SPSS 21.0统计学软件进行分析,正态分布计量资料用均数±标准差(x±s)表示,组间比较采用方差分析(ANOVA);两两比较采用LSD。计数资料用率(%)表示,组间比较采用χ2检验、Fisher确切概率法。非正态分布资料,计量资料用中位数及第25、75百分位数[M(P25, P75)]表示,组间比较采用Kruskal-Wallis检验。P≤0.05为差异有统计学意义。
2 结果 2.1 一般资料共纳入155例血培养阳性早产儿败血症,男性89例,女性66例;顺产92例,剖宫产63例;胎龄24+5~36+6周,平均(28.2±5.3)周;出生体重670~3 400 g,平均(1 010±936)g;起病日龄0.5~106 d,中位数33(20.3, 51.5)d。临床特征中,反复呼吸暂停71例,循环异常75例,腹胀78例。
2.2 病原菌分布155例血培养阳性败血症患儿病原菌分布见表 1。G-菌76株,占49.03%,以肺炎克雷伯菌、大肠埃希菌、黏质沙雷菌为主;G+菌42株,占27.10%,以表皮葡萄球菌、金黄色葡萄球菌、溶血葡萄球菌为主;真菌败血症组37株,占23.87%,以近平滑假丝酵母菌、白假丝酵母菌为主。
| 表 1 155例早产儿败血症病原菌分布 Table 1 Distribution of pathogens in 155 premature infants with septicemia |
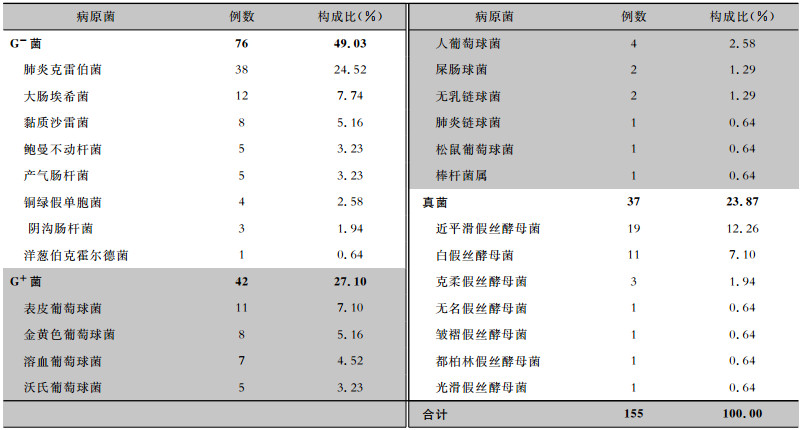
|
G-菌组和真菌组早产儿胎龄、出生体重小于G+菌败血症组,差异均有统计学意义(均P<0.05)。真菌败血症组早产儿起病日龄大于G-菌组、G+菌组,深静脉置管比例高于G-菌组、G+菌组(P<0.05)。G-菌组、真菌组早产儿循环障碍、呼吸暂停发生率高于G+菌败血症组(P<0.05)。见表 2。
| 表 2 三组早产儿一般情况的比较 Table 2 Comparison of general conditions of three groups of premature infants |
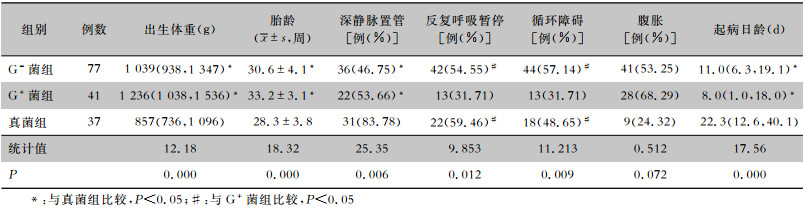
|
真菌组早产儿血小板计数低于G-菌、G+菌组,差异有统计学意义(均P<0.05)。G-菌组早产儿C反应蛋白(CRP)高于G+菌组和真菌组,差异有统计学意义(P<0.05)。见表 3。
| 表 3 三组早产儿实验室指标的比较 Table 3 Comparison of laboratory markers of three groups of premature infants |
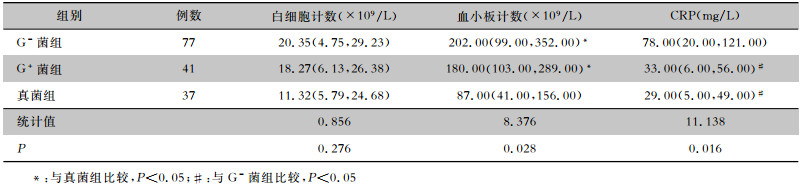
|
155例早产儿治愈好转率94.84%,病死率5.16%。G-菌组早产儿病死率高于G+菌组、真菌组(P<0.05)。G+菌组、真菌组早产儿治愈好转率比较,差异无统计学意义(P>0.05)。真菌败血症组早产儿治疗日数长于G-菌、G+菌组(P<0.05),G-菌、G+菌组在治疗时间上比较,差异无统计学意义(P>0.05)。见表 4。
| 表 4 三组早产儿预后的比较 Table 4 Comparison of prognosis of three groups of premature infants |
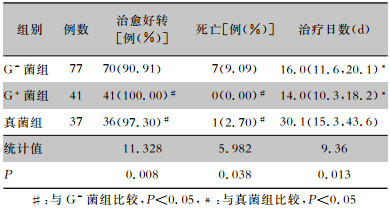
|
G-菌中产超广谱β-内酰胺酶菌株共13株,占17.11%,其中肺炎克雷伯菌11株,产气肠杆菌2株,对哌拉西林、头孢类抗生素耐药率100%,对亚胺培南、美罗培南耐药率较低,其中有3株肺炎克雷伯菌对亚胺培南、美罗培南、哌拉西林、所有头孢类耐药,仅对阿米卡星敏感。G+菌中,共检出3株耐药菌,其中2株为金黄色葡萄球菌,1株为人葡萄球菌,均对青霉素、头孢类耐药,对万古霉素敏感。真菌败血症未发现有耐药情况,对两性霉素B、氟康唑、氟胞嘧啶、伏立康唑均敏感。
3 讨论败血症是早产儿重症感染的主要疾病之一,发病率及病死率较高。但由于早产儿败血症早期缺乏特异性症状[4],病情进展快,且易产生耐药,病死率较高[5]。早产儿免疫功能低下、器官发育不成熟,一旦发生败血症,易致严重感染败血症。本研究中,医院感染败血症主要发生在小早产儿中,特别是胎龄小、体重低的早产儿,由于生后住院时间长,长期使用呼吸机、使用抗菌药物、静脉营养、侵袭性操作较多等,发生败血症的风险大[6-7]。本研究中实验室确诊败血症155例,发病率9.76%。文献[8]报道,出生体重501~1 500 g的早产儿在新生儿重症监护病房(NICU)内败血症发病率高达16%,病死率为15%~50%。因此,早期诊断、精准治疗对提高存活率,改善远期预后至关重要。但目前临床上尚缺乏早期、快速、有效的生物学预警指标。由于不同病原体败血症临床特点的差异,本研究对NICU内G-菌、G+球菌、真菌导致的败血症高危因素、临床特征、实验室特征、预后等进行比较,研究不同病原菌败血症的差异,为临床诊断及治疗提供依据。
近年来,国外报道B族溶血链球菌引起的早发性败血症逐渐减少,凝固酶阴性葡萄球菌引起的晚发性败血症比例逐渐增高[9]。因抗菌药物广泛应用,自二十世纪以来,新生儿败血症病原菌谱发生了巨大变化[10]。从本组资料看,仍以G-杆菌为主[11-12],占49.03%,G+球菌排第二位,真菌排第三位。本研究中早产儿真菌败血症约占早产儿败血症的23.87%,且早产儿胎龄及体重较低。随着医疗技术的进步,越来越多的小胎龄早产儿得以救治成功,以后更需重视真菌感染的预防。G-杆菌组前3位致病菌为肺炎克雷伯菌、大肠埃希菌、黏质沙雷菌,其中肺炎克雷伯菌是最主要的早产儿败血症病原菌,与其他报道[13]一致。G+球菌败血症中仍以表皮葡萄球菌、金黄色葡萄球菌、溶血葡萄球菌为主。真菌感染中近平滑假丝酵母菌排在首位,与近些年来NICU深静脉置管率的增加有关[14]; 排在第二位的为白假丝酵母菌[15], 具体发病机制有待进一步研究证实。
早产儿败血症诊断金标准为微生物培养,但培养时间长,容易延误治疗。近年来,降钙素原、白细胞介素、免疫学、基因诊断学及流式细胞技术有所发展,但仍无一种特异性、敏感性均高的诊断方法[16]。血常规、CRP作为简捷、廉价的检验指标仍应用于临床。本研究中,三类病原菌败血症在血常规、CRP方面存在差异。真菌组早产儿血小板水平低于G-杆菌组、G+球菌组,真菌感染对血小板影响较大[17]。真菌破坏, 消耗血小板,使得血小板大量降低, 早期分析血小板有助于指导早期经验治疗。G-杆菌组早产儿CRP升高, 高于其他组,CRP可用作判断G-杆菌感染的参考指标。真菌组早产儿治疗时间长,病程长,胎龄和体重低。
本研究中,G-杆菌敏感性较高的抗菌药物有碳青霉烯类、阿米卡星及哌拉西林。因氨基糖苷类抗生素有肾毒性、耳毒性,临床上应用较少。G-杆菌对碳青霉烯类抗生素敏感性高,但因其为超广谱抗生素,容易引起多重耐药、菌群失调,所以应尽量控制使用。哌拉西林抗菌活性高,抗菌谱广,可有效控制大多数G-杆菌败血症。本研究中, G-杆菌败血症以肺炎克雷伯菌为主,耐药机制复杂,近年来, 有肺炎克雷伯菌败血症在NICU导致医院感染的暴发。
败血症临床表现多种多样,不同病原体败血症表现有不同。G+球菌组、G-杆菌组早产儿起病时间早,真菌组早产儿起病较晚。G-杆菌组及真菌组早产儿反复呼吸暂停及循环障碍发生率高于G+球菌组。预后方面,G-杆菌组早产儿病死率高于G+球菌组及真菌组,病死率高达9.09%,相比于其他两组,G-杆菌组早产儿临床表现更严重,预后较差。
早产儿败血症是围生期死亡和致残的重要原因,早期发现和诊断具有重要意义。了解上述病原菌败血症特征,以便更好地用于临床早期诊断及精准治疗。由于病例不多,本研究所得结果仅为进一步研究提供线索,具体结果仍有待于进一步多中心大样本的研究。
| [1] |
Rhee C, Klompas M. New sepsis and septic shock definitions: clinical implications and controversies[J]. Infect Dis Clin North Am, 2017, 31(3): 397-413. DOI:10.1016/j.idc.2017.05.001 |
| [2] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [3] |
中华医学会儿科学分会新生儿学组, 中华医学会中华儿科杂志编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. DOI:10.3760/j.issn:0578-1310.2003.12.005 |
| [4] |
INIS Collaborative Group, Brocklehurst P, Farrell B, et al. Treatment of neonatal sepsis with intravenous immune globulin[J]. N Engl J Med, 2011, 365(13): 1201-1211. DOI:10.1056/NEJMoa1100441 |
| [5] |
Li Z, Xiao Z, Li Z, et al. 116 cases of neonatal early-onset or late-onset sepsis: a single center retrospective analysis on pathogenic bacteria species distribution and antimicrobial susceptibility[J]. Int J Clin Exp Med, 2013, 6(8): 693-699. |
| [6] |
姜娜, 汪盈, 王琦, 等. 超早产儿医院感染及其危险因素分析[J]. 中华儿科杂志, 2014, 52(2): 137-141. DOI:10.3760/cma.j.issn.0578-1310.2014.02.013 |
| [7] |
李清红, 何阿玲, 杨军兰, 等. 新生儿败血症早产儿与足月儿的临床特点分析[J]. 中国儿童保健杂志, 2016, 24(7): 765-767. |
| [8] |
Volante E, Moretti S, Pisani F, et al. Early diagnosis of bacterial infection in the neonate[J]. J Matern Fetal Neonatal Med, 2004, 16(Suppl 2): 13-16. |
| [9] |
李秋平, 董建英, 周细中, 等. 不同类型病原体所致早产儿败血症的临床特点[J]. 中华围产医学杂志, 2012, 15(11): 676-682. DOI:10.3760/cma.j.issn.1007-9408.2012.11.010 |
| [10] |
Marchant EA, Boyce GK, Sadarangani M, et al. Neonatal sepsis due to coagulase-negative staphylococci[J]. Clin Dev Immunol, 2013, 2013: 586076. |
| [11] |
杨慧, 黄瑞文, 廖镇宇, 等. 324例早产儿败血症临床分析[J]. 医学临床研究, 2014(12): 2422-2425. |
| [12] |
Fahmey SS. Early-onset sepsis in a neonatal intensive care unit in Beni Suef, Egypt: bacterial isolates and antibiotic resistance pattern[J]. Korean J Pediatr, 2013, 56(8): 332. DOI:10.3345/kjp.2013.56.8.332 |
| [13] |
Panda S, Dohare P, Jain S, et al. Estrogen treatment reverses prematurity-induced disruption in cortical interneuron population[J]. J Neurosci, 2018, 38(34): 7378-7391. DOI:10.1523/JNEUROSCI.0478-18.2018 |
| [14] |
Shane AL, Stoll BJ. Neonatal sepsis: progress towards improved outcomes[J]. J Infect, 2014, 68(Suppl 1): S24-S32. |
| [15] |
Hibbert JE, Currie A, Strunk T, et al. Sepsis-induced immunosuppression in neonates[J]. Front Pediatr, 2018, 6: 357. DOI:10.3389/fped.2018.00357 |
| [16] |
Zea-Vera A, Ochoa TJ. Challenges in the diagnosis and mana-gement of neonatal sepsis[J]. J Trop Pediatr, 2015, 61(1): 1-13. |
| [17] |
花少栋, 王瑞娟, 黄捷婷, 等. 早产儿假丝酵母菌败血症时血小板的变化[J]. 中国新生儿科杂志, 2012, 27(5): 312-315. DOI:10.3969/j.issn.1673-6710.2012.05.006 |



