人肠道病毒(Human enterovirus, HEV)属小RNA病毒科(Picornaviridae)中的肠道病毒属,是重要的人类致病原,作为普通的机会性感染病原体可感染各年龄人群,但婴幼儿的发病率明显高于成人。HEV的传染性较强,可引起流行和暴发,导致感染者的发病和死亡。HEV包括脊髓灰质炎病毒(Poliovirus)、A组柯萨奇病毒(Coxsackie virus A)、B组柯萨奇病毒(Coxsackie virus B)、埃可病毒(Echovirus, EchoV)及新型肠道病毒,可导致脑(膜)炎、支气管炎、心肌炎、手足口病、弛缓性麻痹、1型糖尿病等疾病。其中由EchoV导致的感染较重,特别是新生儿在医院获得的感染,往往导致暴发流行。新生儿可通过胎盘、产道或出生后获得感染,可因母亲、医护人员等导致交叉感染,在新生儿病房暴发流行,绝大多数致死性肠道病毒感染是由EchoV 11所致[1-2]。近年来,我国由EchoV引起的感染暴发疫情时有发生,传染性强。2019年广东某医院发生的新生儿EchoV感染,导致5例致死性病例,后果严重,影响力极大。目前,尚未见针对EchoV感染的疫苗,一旦发现疑似EchoV感染的患儿,应及时进行病原学检测,采取有效措施,早隔离并积极治疗患儿。若发生医院感染暴发,应在积极治疗患儿的同时进行流行病学调查,寻找导致感染暴发的原因。各级医疗机构医务工作者,需高度重视该疾病的相关信息,做好感染诊治及医院感染防控工作。在以后的研究中要探索病毒在人群中的传播规律,争取早日实现肠道病毒计划免疫。此文对EchoV感染特征及医院感染防控要点进行综述,以期为EchoV感染诊治及医院感染防控工作提供帮助。
1 EchoV病原学特点及流行病学 1.1 EchoV病原特点EchoV是小核糖核酸病毒科中HEV的成员,构成最大的HEV亚组。EchoV是常见的人类病原体,可引起一系列疾病,从轻微的发热到严重的、可能致命的疾病,如无菌性脑膜炎、脑炎、瘫痪、心肌炎等[3]。在所有年龄段的人群中均可致病,可导致地方性流行和暴发。术语“ECHO”病毒表示“enteric cytopathic human orphan”,翻译为“肠道细胞病变人类孤儿”病毒,通过人与人之间的传播反映病毒的肠道传播特点。
EchoV最初被分为34种血清型,随着研究进展,目前EchoV 10已被重新分类为呼肠孤病毒1,EchoV 28被重新分类为为鼻病毒1,现在认为EchoV 9与柯萨奇病毒A23相同。EchoV 22和23已被重新分类为细小病毒属的成员,而EchoV 34是柯萨奇病毒A24的变体[4],目前EchoV共有31或32型。不同血清型导致的疾病具有不同的临床表现,血清型的变化和相同亚型的基因型变异可能与大规模暴发相关[5]。
EchoV是具有二十面体构型的小的无包膜病毒。衣壳包含由4种蛋白质VP1~VP4组成的60个亚基。这些蛋白质在确定宿主范围和趋向性,以及将RNA基因组呈递至宿主细胞的细胞质方面发挥重要作用。在很宽的pH范围内(3~10), EchoV均具有感染性,且对乙醚和乙醇具有抗性。
1.2 EchoV感染流行病学EchoV在世界各国均有病例报道,无种族特异性。EchoV感染率随季节、地理位置以及抽样人口的年龄和社会经济状况而变化,较低社会经济群体的感染归因于过度拥挤的生活条件和不良的卫生条件。在热带气候中全年都会发生感染,在温带气候中,感染在夏季和初秋期间更为普遍,如我国南方地区。发病率与性别有一定关系,但原因不明,感染后男性出现症状的风险更高,达50%[6]。其中无菌性脑膜炎,男孩几乎是女孩的两倍。怀孕期间的EchoV感染很常见,有病例报告描述了出生后不久的垂直传播,可能产生严重后果[7]。另外,年龄也有一定相关性,世界卫生组织(WHO)报告的四分之三的肠道病毒感染(包括EchoV)发生在15岁以下的儿童。在美国,1岁以下婴儿的发病率远超过年龄较大的儿童和成人[8]。美国国家肠道病毒监测系统(NESS)报告,2014—2016年D68是最常报告的EchoV类型,其次是EchoV 30、柯萨奇病毒A6、EchoV 18和柯萨奇病毒B3[9]。泰国一所医院报告了由EchoV 11导致的手足口病医院感染暴发[10]。2018年我国多个地区报道了EchoV 30导致的病毒性脑炎流行病例[11-14]。2006—2010年在消灭脊髓灰质炎急性弛缓性麻痹(acute flaccid paralysis,AFP)病例监测工作中,从15岁以下AFP病例的粪便标本中分离到大量的非脊髓灰质炎肠道病毒,对四川省AFP病例标本中分离到的非脊髓灰质炎肠道病毒进行分型,发现EchoV 11是其中的优势流行株之一[6]。
2 EchoV感染传播途径及致病机制EchoV感染主要通过粪-口途径传播,也可经飞沫传播和黏膜接触传播,宿主易感性取决于特定细胞膜受体蛋白的存在。衰变加速因子(decay-accelerating factor, DAF)可能是一种主要的EchoV受体,可结合多种EchoV血清型,包括7、11、12、20、21、29和33型。EchoV血清型1和8结合晚期抗原(very late antigen, VLA)整合素分子的α2亚基。最近研究[15]发现,新生儿Fc受体(neonatal Fc receptor, FcRn)(上皮细胞主动转运免疫球蛋白IgG的受体)可能与新生儿对EchoV感染的易感性有关。原发感染后,病毒外排最长持续时间咽部为3~4周,肠道为5~6周。在胃肠道中病毒进入和初始复制的确切位点尚不确定,但研究已经证实肠黏膜M细胞(一种免疫细胞)中存在EchoV。回肠淋巴组织在摄入后1~3 d内显示EchoV复制,复制后EchoV扩散到区域淋巴结并引起亚临床短暂病毒血症,随后病毒扩散到网状内皮组织,包括肝、脾、骨髓和远端淋巴结。感染的次要部位包括中枢神经系统、肝、脾、骨髓、心脏和肺。超过90%的EchoV感染是无症状的。当疾病发生时,症状从发热到严重的疾病表现,取决于宿主年龄、性别、免疫状态和病毒亚组的血清型[16]。
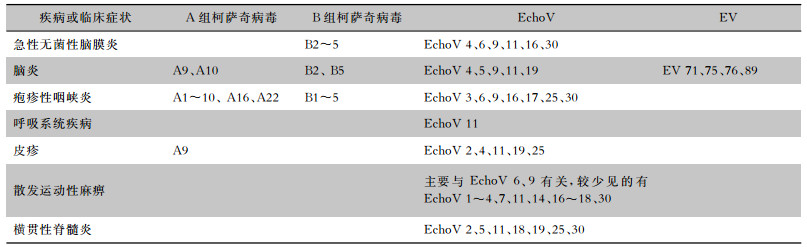
3 EchoV感染临床表现50%~80%的EchoV感染患者表现为无症状,最常见的表现是非局灶性、无症状的发热性疾病。疾病可由任何EchoV血清型引起,临床症状上与许多其他肠道病毒感染无法区分。见表 1。
| 表 1 EchoV及其他肠道病毒不同亚型导致的疾病种类或临床症状 |
|
最常见的血清型是B组柯萨奇病毒血清型2~5和EchoV 4、6、9、11、16和30型。无菌性脑膜炎最常与EchoV 30感染有关[3]。急性无菌性脑膜炎表现为在没有细菌或真菌感染的情况下有脑膜刺激症和脑脊液(CSF)细胞增多症的体征和症状。CSF细胞计数通常为10~500/μL,并且可能早期显示中性粒细胞占优势,但易转变为淋巴细胞占优势[16]。起病可能是渐进的或突然的。EchoV脑膜炎可能具有双相模式,发热和肌痛伴临床退热,随后又出现发热和头痛,预示着脑膜炎的发生。脑膜炎症状从轻微到严重不等,只有约三分之一的患者表现出Kernig和Brudzinski征。据报道,5%~10%的病例可能出现高热惊厥、嗜睡、昏迷和运动障碍等并发症,并可能与脑炎型疾病重叠。与年轻患者相比,成年人可能会经历更长时间的发热和疾病过程,而症状严重的患者可能会在1~2周内丧失正常活动能力[16]。
3.2 脑炎脑炎发生非常罕见,柯萨奇病毒类型A9、A10、B2和B5,EchoV 4、5、9、11和19型,以及肠道病毒(EV)71、75、76和89是最常报告的血清型。症状包括昏睡、嗜睡、性格改变、癫痫发作、麻痹和昏迷[17]。
3.3 疱疹性咽峡炎一种典型的、泡状的、涉及扁桃体窝和软腭的口腔黏膜病变,此病通常夏季容易发生暴发流行。发病儿童通常年龄小于10岁,青少年和年轻人中较少见该病。症状包括体温升高、咽炎和吞咽困难,伴有非持续性呕吐、肌痛和头痛,其中咽痛和吞咽困难是突出症状。A组柯萨奇病毒(血清型1~10、16和22)最常见于疱疹性咽峡炎的患者。其他较不常见的分离血清型,包括B组柯萨奇病毒1~5和EchoV 3、6、9、16、17、25和30。
3.4 呼吸系统疾病与许多EV相似的EchoV可能与发热性疾病(所谓的夏季流行性感冒)有关,伴有咽痛、咳嗽或鼻炎,EchoV 11可与喉炎相关。血清型EchoV 11是呼吸系统疾病最可能的原因。
3.5 皮疹与其他EV感染相比,EchoV感染更易出现皮疹。可以是斑丘疹、麻疹样、黄斑、瘀点或丘疹样脓疱。风疹样皮疹相关的血清型包括柯萨奇病毒A9和EchoV 2、4、11、19和25。囊泡疱疹样疹与柯萨奇病毒A9和EchoV 11有关。
3.6 流行性胸膜炎胸膜痛的特征是突然发热和涉及肋间肌肉的剧烈疼痛痉挛,疼痛通常很难定位,严重程度个体差异很大。疼痛还可能涉及腹肌,类似急腹症,通常影响老年人,儿童的病程较轻,疼痛剧烈但具有自限性,大多数患者在一周内恢复,约25%可能在第一次发作后一个月内复发。
3.7 麻痹和其他神经系统并发症EchoV引起的麻痹性疾病通常不如脊髓灰质炎病毒相关的麻痹突出。肌无力比弛缓性麻痹更常见,通常不是永久性的。颅神经受累,通常表现为动眼神经麻痹。散发性运动麻痹的散发病例与EchoV 6和9有关。较少涉及的血清型包括EchoV 1~4、7、11、14、16~18和30[18]。部分EchoV 2、5、11、18、19、25和30感染表现为横贯性脊髓炎[19]。
3.8 心肌/心包疾病心肌炎通常与上呼吸道感染有关,可能发生在任何年龄,但在青少年和年轻人中似乎尤为突出。男性受到的影响是女性的两倍。在多数情况下,常见症状包括呼吸急促、胸痛、发热和乏力。
4 实验室检查 4.1 血常规白细胞计数(WBC)可正常或轻度升高。
4.2 病毒分离细胞培养分离病毒是EchoV感染的主要实验室诊断方法,不同血清型之间分离率有所不同。可以通过分离血液、CSF、组织或心包液中的病毒证实诊断,咽部和粪便培养可能有帮助,但无法确认诊断,因为无症状肠道脱落可在急性感染后持续数周,多部位采样可增加细胞培养阳性率。
4.3 血清学目前,用血清型特异性免疫反应测定较常见的EV抗体。ELISA法测定特异性IgM抗体阳性,或感染极期与恢复期双份血清IgG抗体滴度4倍以上增加有助于诊断。但EchoV感染的血清学检测价值有限,取决于急性期和恢复期的抗体滴度,并且不是特异性的,单个抗体结果通常无意义,获取结果缓慢。
4.4 分子生物学技术目前,PCR反应广泛用于临床标本检测EV-RNA,尤其在检测CSF、呼吸道分泌物和尿中EV时,比培养更敏感。由于粪便中某些物质抑制PCR反应,故粪便标本阳性率低。
4.5 其他(1) 影像学。由于心包积液或心脏扩张,约50%的病例中心肌炎导致胸部X线片上的心脏轮廓增大。(2)超声心动图。可确认是否存在急性心室扩张,心脏射血分数降低或心包积液。(3)心电图。心包炎和心肌炎会产生心电图改变,包括ST段抬高或非特异性ST段和T波异常。严重的心肌疾病可能导致Q波、室性快速性心律失常和所有程度的心脏传导阻滞。(4)组织学。在心肌炎中,病毒在胃肠道或呼吸道中复制后的病毒血症期间到达心脏。小鼠模型实验研究表明病毒复制发生在肌细胞中。当复制病毒不再存在于心脏中时,慢性炎症反应持续数周至数月,有研究者认为晚期炎症反应是由于病毒诱导的细胞毒性T淋巴细胞对心肌细胞的损伤。
5 EchoV感染诊断依据流行病学资料,完整的病史评估,结合上述实验室检查可进行诊断,包括分离培养到EchoV,血清学检测特异性IgM抗体阳性或感染极期与恢复期双份血清IgG抗体滴度4倍以上增加,分子生物学检测到EchoV-RNA以及组织病理学特征。
6 EchoV感染治疗治疗EchoV感染无具体的抗病毒治疗方法,大多数EchoV感染是自限性的,不需要特殊治疗,对症支持治疗是关键。Pleconaril是一种对大多数EV具有体外活性的制剂,临床试验中对其进行了评估,但尚未被美国食品药品监督管理局(FDA)批准用作抗病毒制剂[20-21],其作用机制为结合VP1蛋白[22]。静脉注射丙种球蛋白(IVIG)已被用于治疗持续性EchoV感染的免疫功能低下患者,但IVIG在严重感染中的作用尚未经过充分的临床验证。
7 EchoV医院感染防控措施EchoV感染的危害主要在于易导致医院感染暴发流行,需引起高度警惕。目前,尚未见针对EchoV感染的疫苗。一旦发现疑似EchoV感染的患儿,应及时进行病原学检测,采取有效措施,早隔离并积极治疗患儿,若发生医院感染暴发,应在积极治疗患儿的同时进行流行病学调查,寻找导致感染暴发的原因。
EchoV在结构上是一种无包膜病毒,可以在包括玻璃和棉织物在内的家用物品上保持活性,持续时间2~12 d,甚至更长,特别是在有机材料,灰尘和大肠菌群的存在下存活时间更长[23]。在海水和淡水中,EchoV分别将感染性维持在数天至数周,最长达8周,浑浊度和悬浮固体物质是影响其生存力的因素[24],因此,水的处理十分重要。在医院,环境表面消毒十分重要,EchoV对乙醚和乙醇有抵抗性,关于消毒剂的选择可参考《医疗机构消毒技术规范》(2015版)选择合适的消毒剂。美国疾病控制与预防中心(CDC)官方网站报道,对EchoV,采用含有效氯0.48~0.52 mg/L的消毒剂,接触时间为1.8 min,病毒失活率为99%[25]。
鉴于EchoV的粪-口传播途径,强调手卫生和隔离的重要性,是控制感染播散,切断感染传播途径的最重要措施。为预防医院新生儿EchoV感染,特别是在新生儿病房的流行,建议做好如下隔离措施:(1)入院时高度怀疑EchoV感染的患儿未确诊前即给予隔离,疑似病例与确证病例需要分开隔离,条件需符合《医院隔离技术规范》(2012版)的要求;(2)接触患儿皮肤、黏膜等可复用的器械、器具及物品应当专人专用,用后需彻底消毒/灭菌;(3)患儿的奶瓶、奶嘴及其他物品需要单独使用,一用一消毒或灭菌;(4)患儿粪便单独处理,防止交叉污染;(5)加强母乳接收、储存与配方奶使用的管理,防止交叉污染;(6)医务人员接触患儿前后洗手,必要时戴橡胶手套,穿隔离衣;(7)隔离单元物体表面和地面每天使用有效消毒剂擦拭;(8)新生儿EchoV感染者、患儿临床症状好转后,仍可在粪便中检测到病毒,仍具有传染性,隔离时间应大于5~6周,预防交叉感染。
8 小结在我国EV导致的感染包括由EchoV导致的无菌性脑膜炎及相关疾病,不属于法定报告传染病,同时也缺乏较全面的流行病学资料,但近年来EchoV所致疾病呈上升趋势,各地区疾病预防与控制中心调查发现,EchoV感染呈现地区流行趋势,除社区获得性感染发病率升高外,还导致了医院感染暴发,后果严重。因此,各级医疗机构医务工作者,需高度重视该疾病的相关信息,做好感染诊治及医院感染防控工作。在以后的研究中要探索病毒在人群中的传播规律,争取早日实现肠道病毒计划免疫。
| [1] |
Feign RD, Cherry JD, Demmler-Harrison GJ, et al. Feign and Cherry's textbook of pediatric infectious diseases[M]. Philadephia, Elsvier, 2009: 2110-2146.
|
| [2] |
Khetsuriani N, LaMonte A, Oberste MS, et al. Neonatal enterovirus infections reported to the national enterovirus surveillance system in the United States, 1983-2003[J]. Pediatr Infect Dis J, 2006, 25(10): 889-893. DOI:10.1097/01.inf.0000237798.07462.32 |
| [3] |
Centers for Disease Control and Prevention. Enterovirus surveillance-United States, 2002-2004[J]. MMWR Morb Mortal Wkly Rep, 2006, 55(6): 153-156. |
| [4] |
King AMQ, Lefkowitz EJ, Mushegian AR, et al. Changes to taxonomy and the international code of virus classification and nomenclature ratified by the international committee on taxonomy of viruses (2018)[J]. Arch Virol, 2018, 163(9): 2601-2631. DOI:10.1007/s00705-018-3847-1 |
| [5] |
Yarmolskaya MS, Shumilina EY, Ivanova OE, et al. Molecular epidemiology of Echoviruses 11 and 30 in Russia:Different properties of genotypes within an enterovirus serotype[J]. Infect Genet Evol, 2015, 30: 244-248. DOI:10.1016/j.meegid.2014.12.033 |
| [6] |
陈娜, 马小珍, 童文彬, 等. 2006-2010年埃可病毒11型四川分离株的基因特征分析[J]. 现代预防医学, 2016, 43(9): 1649-1652. |
| [7] |
Modlin JF. Fatal Echovirus 11 disease in premature neonates[J]. Pediatrics, 1980, 66(5): 775-780. |
| [8] |
Wilfert CM, Lauer BA, Cohen M, et al. An epidemic of Echovirus 18 meningitis[J]. J Infect Dis, 1975, 131(1): 75-78. |
| [9] |
Abedi GR, Watson JT, Nix WA, et al. Enterovirus and Parechovirus surveillance-United States, 2014-2016[J]. MMWR Morb Mortal Wkly Rep, 2018, 67(18): 515-518. DOI:10.15585/mmwr.mm6718a2 |
| [10] |
Apisarnthanarak A, Kitphati R, Pongsuwann Y, et al. Echovirus type 11:outbreak of hand-foot-and-mouth disease in a Thai hospital nursery[J]. Clin Infect Dis, 2005, 41(9): 1361-1362. DOI:10.1086/497076 |
| [11] |
欧初贵. 埃可病毒30型所致脑炎暴发疫情的调查研究[J]. 黑龙江医药, 2018, 31(2): 264-266. |
| [12] |
陈建华, 朱贞, 李煜山, 等. 甘肃省瓜州县一起由埃可病毒30引致的无菌性脑炎疫情病原学分析[J]. 病毒学报, 2016, 32(6): 721-726. |
| [13] |
姚学君, 张雪峰, 沈进进. 中国部分地区埃可病毒30型分离株VP1区基因序列的特征分析[J]. 现代预防医学, 2019, 46(4): 700-704. |
| [14] |
刘愉, 邓琳菲, 刘颖, 等. 埃可病毒30型脑炎患儿CD4+、CD8+及CD3+T淋巴细胞免疫功能分析[J]. 中国妇幼保健, 2018, 33(21): 4910-4913. |
| [15] |
Morosky S, Wells AI, Lemon K, et al. The neonatal Fc receptor is a pan-Echovirus receptor[J]. Proc Natl Acad Sci USA, 2019, 116(9): 3758-3763. DOI:10.1073/pnas.1817341116 |
| [16] |
Spencer RC. Mandell, Douglas and Bennett's principles and practice of infectious disease[M]. 5th Ed, Mycopathologia, 2000, 149(1): 47-48.
|
| [17] |
Jain S, Patel B, Bhatt GC. Enteroviral encephalitis in children:clinical features, pathophysiology, and treatment advances[J]. Pathog Glob Health, 2014, 108(5): 216-222. DOI:10.1179/2047773214Y.0000000145 |
| [18] |
Dhole TN, Ayyagari A, Chowdhary R, et al. Non-polio enteroviruses in acute flaccid paralysis children of India:Vital assessment before polio eradication[J]. J Paediatr Child Health, 2009, 45(7-8): 409-413. DOI:10.1111/j.1440-1754.2009.01529.x |
| [19] |
Moline HL, Karachunski PI, Strain A, et al. Acute transverse myelitis caused by Echovirus 11 in a pediatric patient:case report and review of the current literature[J]. Child Neurol Open, 2018, 5: 2329048X17751526. |
| [20] |
Benschop KS, Wildenbeest JG, Koen G, et al. Genetic and antigenic structural characterization for resistance of Echovirus 11 to pleconaril in an immunocompromised patient[J]. J Gen Virol, 2015, 96(Pt 3): 571-579. |
| [21] |
Bernard A, Lacroix C, Cabiddu MG, et al. Exploration of the anti-enterovirus activity of a series of pleconaril/pirodavir-like compounds[J]. Antivir Chem Chemother, 2015, 24(2): 56-61. DOI:10.1177/2040206615589035 |
| [22] |
Schmidtke M, Hammerschmidt E, Schüler S, et al. Susceptibility of Coxsackievirus B3 laboratory strains and clinical isolates to the capsid function inhibitor pleconaril:antiviral studies with virus chimeras demonstrate the crucial role of amino acid 1092 in treatment[J]. J Antimicrob Chemother, 2005, 56(4): 648-656. DOI:10.1093/jac/dki263 |
| [23] |
Kiseleva L. Survival of enteric viruses in water and food stuffs and on various surfaces[J]. Hygiene Sani, 1968, 33: 439-440. |
| [24] |
Rzezutka A, Cook N. Survival of human enteric viruses in the environment and food[J]. FEMS Microbiol Rev, 2004, 28(4): 441-453. DOI:10.1016/j.femsre.2004.02.001 |
| [25] |
CDC. Effect of chlorination on inactivating selected pathogen[EB/OL]. (2012-03-21)[2019-07-01]. https://www.cdc.gov/safewater/effectiveness-on-pathogens.html.
|



