2. 首都医科大学附属北京地坛医院病理科, 北京 100015
2. Department of Pathology, Beijing Ditan Hospital, Capital Medical University, Beijing 100015, China
黄热病(yellow fever)是一种在非洲和南美洲热带地区流行的病毒性疾病,病死率高达20%~50% [1]。2016年以前我国无黄热病报道,2016年安哥拉暴发黄热病疫情[2],当地有华人感染并死于黄热病,我国出现输入性病例的风险增高。2016年3—4月,我国共报告11例输入性黄热病病例[3-4],进化树分析表明,我国输入性病例的病毒序列与本次疫情疫源地安哥拉的病毒同源。2016年3月我院收治1例32岁的中国男性患者[5],该患者在安哥拉发病后回国,住院后诊断为中国第一例输入性黄热病病例,通过Vero细胞进行病毒分离,该病毒基因组全长10 823个碱基,属于Angola71基因型,与安哥拉分离的黄热病毒具有高度同源性。尽管该病毒在安哥拉流行了45年,仅14个氨基酸置换,与1971年基因型相比,病毒膜蛋白和包膜蛋白未发生氨基酸变异。该患者临床表现为发病第3天时出现出血、黄疸和少尿,迅速进展为多器官功能衰竭,肝、胰腺、心肌酶学均显著升高,尽管给予了高级生命支持,患者于发病第9天死亡,肝活检病理表现为严重的多小叶性坏死,血液病毒核酸监测提示,病毒持续存在。我院在收治首例重型黄热病患者后,又陆续收治了4例从安哥拉返回的黄热病患者,其中重型1例,轻型3例,均治愈出院。为提高我国对输入性黄热病疫情的认识及救治水平,对4例存活病例进行半年、一年的随访研究,以探讨黄热病的急性病程及半年、1年的转归,现报告如下。
1 对象与方法 1.1 研究对象2016年北京地区收治的5例输入性黄热病患者。
1.2 研究方法收集患者一般资料、人口学资料、流行病学史、症状、体征、实验室检查等,对诊疗过程进行总结,在发病后半年、1年对患者进行随访,动态监测血常规、肝功能、肾功能、T细胞亚群等,复查腹部超声,随访时重型患者进行肝穿刺病理检查。
1.3 诊断标准依据国家卫生计生委办公厅黄热病诊疗方案(2016年版)进行诊断[6]。根据流行病学史、临床表现和相关实验室检查综合判断。发病前14 d内有在黄热病流行地区居住或旅行史,蚊虫叮咬史,有难以用其他原因解释的发热、黄疸、肝肾功能损伤或出血等,应考虑疑似病例,如果黄热病毒IgM抗体检测阳性即可作出临床诊断。实验室黄热病毒核酸检测阳性,分离出黄热病毒,恢复期血清黄热病毒抗体滴度较急性期呈4倍及以上升高,同时排除登革热、疟疾、寨卡病毒等其他常见病毒感染即可确定诊断。本组病例均为病原学明确的确诊病例,其中首例患者由北京疾病预防控制中心(CDC)检测,中国CDC复核确诊,其余4例由北京CDC应用中国CDC提供的引物和探针试剂盒检测黄热病毒进行诊断。
2 结果 2.1 一般资料5例患者均为发病后从安哥拉首都罗安达返回的华人,在安哥拉从事商业或建筑工作,均有蚊虫叮咬史,在安哥拉居住时间4个月~7年,仅1例曾接种黄热病疫苗。病例1入院后对其血标本进行动态核酸监测,发现直至病程第9天死亡时血核酸仍为阳性,但病毒载量逐渐降低。其余4例患者在入院后采集血、尿、唾液、咽试子进行核酸检测,患者病程均已大于1周,检测时间点为病程第8~14天,血核酸检测均为阴性,所有患者尿核酸检测均为阳性,但仅有病例3的唾液核酸检测阳性,所有病例咽试子核酸检测均为阴性。见表 1。
| 表 1 黄热病患者一般资料及不同标本核酸检测结果 Table 1 General data of patients with yellow fever and nucleic acid detection results of different specimens |
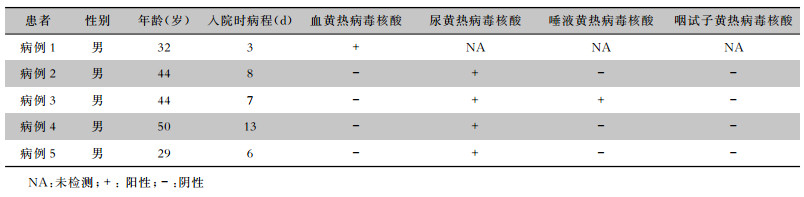
|
本组病例重型患者2例,轻型患者3例。所有患者均出现典型的黄热病感染症状,出现典型的寒战、发热(最高达39.5 ℃),全身不适,食欲不振、头痛、乏力、肌痛,呼吸道症状轻微,部分患者出现尿黄,1例患者表现为出血性皮疹,1例患者表现为充血性皮疹。其中1例重型患者表现为严重肝肾衰竭,虽经各种呼吸机、血液滤过、血浆置换等高级生命支持,仍在发病第9天死亡;另1例重型患者出现严重肝功能损伤、肝昏迷,因意识障碍需气道保护而转ICU进行治疗,在ICU监护5 d后撤除呼吸机,转回普通病房继续治疗。除第1例死亡之外,其余4例均好转出院。见表 2。对所有生存病例进行半年、1年随访,至半年随访时仅有2例患者偶有乏力,其他患者均无明显症状,1年随访时所有患者均无不适症状。
| 表 2 黄热病患者急性期主要临床表现及转归 Table 2 Main clinical manifestations and prognosis of patients with yellow fever in acute phase |
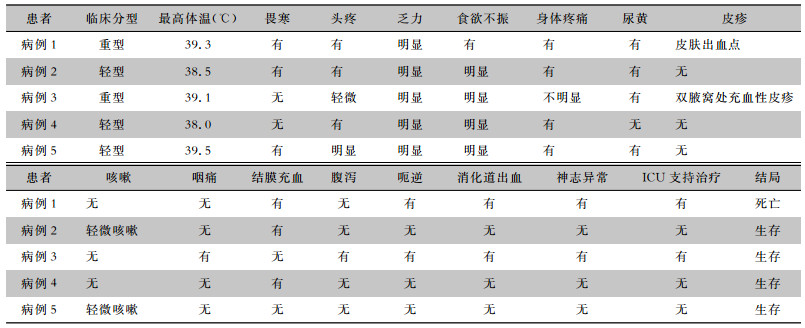
|
病例1入院时处于病程第3天,表现为严重的肝肾衰竭、凝血功能障碍、血淀粉酶升高等。其余4例,入院时病程均大于1周,所有患者均出现转氨酶不同程度升高,其中病例3出现严重肝损伤、血氨升高、PTA下降,出现肝昏迷表现。入院时,2例患者血小板降低,1例患者存在贫血,4例患者心肌酶升高,3例患者血淀粉酶、脂肪酶升高。4例存活病例都进行了半年随访,3例(病例2~4)进行了1年随访。轻型病例在半年时生化指标均已恢复正常,仅1例重型患者(即病例3)在半年随访时肝功能尚未恢复正常,表现为转氨酶及胆红素升高,但在1年随访时肝功恢复正常。见表 3。
| 表 3 黄热病患者急性期与半年、1年随访实验室检查 Table 3 Laboratory examination of patients with yellow fever in acute phase, follow-up for half a year and one year |
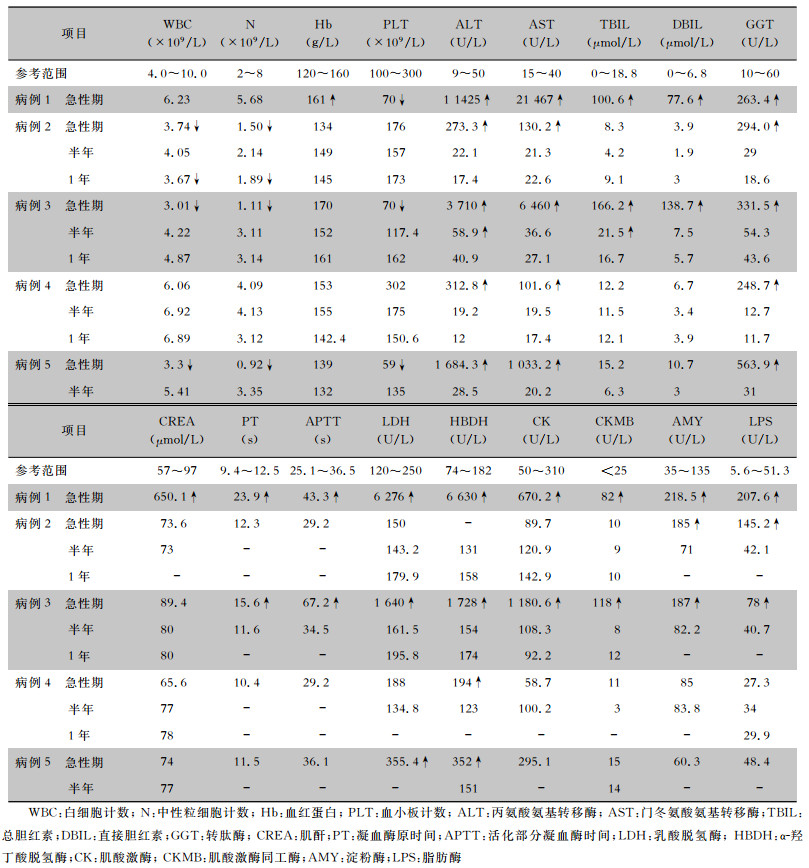
|
入院后,检测所有患者T细胞亚群,并进行动态监测,半年、1年随访时再次进行检测。急性期重型患者CD4+T淋巴细胞计数(参考范围:706~1 125 cells/μL)显著降低,病例1降至155 cells/μL,病例3降至75 cells/μL。3例轻型患者中,病例5在病程第6天入院时CD4+T淋巴细胞降低至534 cells/μL,其他2例轻型患者(病例2、4)入院时分别为病程第10、14天,CD4+T淋巴细胞计数正常。半年随访时,3例轻型患者CD4+T淋巴细胞计数均恢复正常。存活的重型患者,在半年随访时CD4+T淋巴细胞计数333 cells/μL,1年随访时升至519 cells/μL,CD4+T淋巴细胞计数逐渐恢复,但仍低于正常范围。5例患者均实验室检查排除了HIV感染。
2.5 黄热病患者急性期腰穿检查特点2例重型(病例1、病例3)及2例轻型(病例2、病例4)患者进行了腰穿检查。病例1(重型死亡)脑脊液压力升高>330 mmH2O,脑脊液白细胞5/μL,蛋白升高268.6 mg/dL, 病例3(重型,生存)患者腰穿困难,存在损伤,未测压,白细胞升高54/μL,单核细胞占48%,多核细胞占52%,蛋白升高88.6 mg/dL。2例轻型患者腰穿检查均正常。
2.6 黄热病患者肝穿刺病理检查特点本组病例中共有3例患者在病程急性期或恢复期进行了肝穿病理检查。其中第1例死亡患者在病程第9天的肝病理提示严重的多小叶性坏死,有广泛的小叶内融合性坏死,以中央静脉周围区域显著。1例轻症患者存在中度的肝损伤,在病程第9天进行肝穿,病理提示肝组织轻度炎症,肝板排列尚可,小叶内散在少量的点灶状坏死,汇管区轻度扩大,淋巴细胞浸润,汇管区纤维组织轻度增生,符合病毒感染之肝改变。存活的危重症患者在半年时肝穿提示轻度慢性肝炎伴肝细胞脂肪变性(F1G1S1),小叶内肝板排列尚整,也有散在的点灶状坏死,并且有散在的肝细胞大泡性脂肪变性,分布倾向于小叶Ⅲ区,汇管区有轻度炎症,纤维组织有轻度增生;一年时肝穿显示仍存在慢性炎症表现,但小叶内炎症改变较前变轻,点灶状坏死变少,但肝脂肪变性程度加重,小叶内有以Ⅲ区为主的大泡及小泡性混合性脂肪变性,约占40%,病理诊断为脂肪性肝炎(F2G1S1)。脂肪变加重考虑与非病毒因素有关。
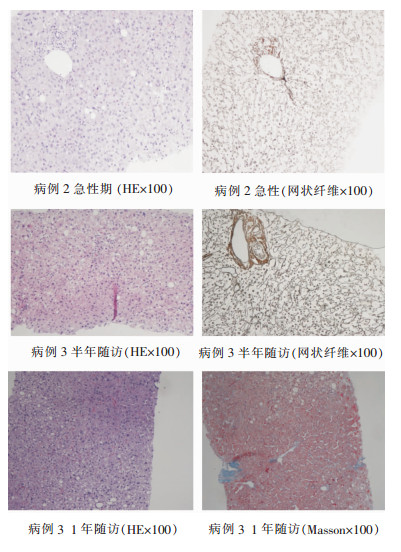 |
| 图 1 黄热病患者肝穿刺病理检查结果 Figure 1 Pathological results of liver puncture in patients with yellow fever |
黄热病是黄热病毒引起的急性传染病,经蚊传播,属于国际检疫传染病。临床主要表现为发热、黄疸、出血等,本病主要在中南美洲和非洲的热带地区流行,在蚊和非人灵长类之间周期性地发生自然感染循环。本次疫情暴发于安哥拉,最早发现于2015年12月[7],截至2016年10月,安哥拉报告了超过4 300例疑似病例,其中376例死亡,病死率8.8%,其中884例为确诊病例,且此数据可能被严重低估[8]。以往我国无黄热病病例报道,仅有少数黄热病疫苗导致嗜内脏损害病例报告[9]。我国对本病的认识主要来自于国外研究及文献,本报告是我国首次对该病进行系统观察及随访。
典型的黄热病临床过程分为4期,病毒血症期、缓解期、肝肾损伤期、恢复期[1, 10]。缓解期是指感染期发病的3~5 d后出现12~24 h的缓解期,表现为体温下降,头痛消失,全身基本状况改善。此期体内病毒被清除,血中可以查到非感染性免疫复合物,轻度患者在此期可以痊愈,而约15%~25%的患者自缓解期后进入肝肾损伤期。本组病例中,尤其是病例1[5],患者表现为早期发热、畏寒、头痛、高热,但体温很快降至正常,且未再出现第二次发热,来本院就诊时为发病第60小时,入院时一般情况尚可,有恶心、呕吐,未诉其他明显不适,但患者存在皮肤巩膜黄染、周身散在出血点、少尿等预后不良的体征,实验室检查提示严重肝肾衰竭、凝血功能紊乱、DIC,病情逐渐加重,出现肝昏迷、呼吸衰竭,病原学检测提示血黄热病病毒核酸阳性,至发病后第9日死亡,患者血病毒核酸仍为阳性,与以往缓解期病毒清除的认识存在差异。
病例3也是一例重型患者,相对于第1例患者病情较轻,未出现肾衰竭、DIC表现,主要为严重肝损伤、肝昏迷、胰腺损伤、出血,患者入院时为病程第8日,血病毒核酸已经阴性,无从知晓该例患者血清核酸具体在哪一天转阴,患者亦不能详述早期是否存在明确缓解期症状。但从此2例重型患者疾病进展规律可见,病情持续进展是明确的,临床症状的缓解只是相关部分症状(体温下降)的缓解,存在其他预示死亡的体征,如出血点、少尿,以及生化指标的恶化,所以该期务必重视,早期处置是提高救治成功率的关键。
本组病例中病例1死亡,该患者病情危重,发病第3天的检验结果显示,患者脏器损伤广泛而严重。患者发病后由当地返回北京,旅途劳顿,可能加重了病情。若当地具备良好的医疗条件,患者未经劳累加重,不知是否有机会存活。个体因素及高病毒载量可能是患者预后极差的主要原因。
黄热病的脏器损伤是广泛的,主要涉及肝、肾、心、脾等[1],本组病例中所有患者均出现了肝损伤,其次是心肌损伤、胰腺损伤,2例重型患者出现神经系统症状,1例死亡病例出现肾损伤。肝功异常的持续时间较长,一般转氨酶升高可持续数月。本组轻型病例在半年随访时肝功均已恢复正常,生存的重型患者在半年时仍有轻度肝功能异常,至1年时恢复,但其肝脂肪变分级由1级加重至2级。Denis等[11]报告2例从巴西返回法国的黄热病合并肝炎患者,其肝功异常持续超过6个月,且在发病2个月后再次出现肝炎反弹,未检测到黄热病核酸及其他病原体,考虑肝炎反弹的原因与免疫因素有关。施军平等[12]对慢性乙型肝炎患者肝细胞脂肪变的发生率及其危险因素进行分析,认为肝细胞脂肪变在慢性乙型肝炎患者中并不少见,其发生主要由患者的代谢因素所致,而与乙型肝炎病毒本身无关,肝细胞脂肪变与肝组织病理损伤程度之间也无明显相关。刘景春等[13]对慢性丙型病毒性肝炎合并肝脂肪变的相关因素进行研究,认为慢性丙型病毒性肝炎患者合并肝脂肪变与身高体重指数、腰臀比及糖脂代谢紊乱密切相关,而与丙型肝炎病毒无关。病例3患病前身高体重指数为27.4 kg/m2,患病期间体重下降,恢复期体力较以往明显下降,至1年随访时身高体重指数恢复至27.4 kg/m2,血脂代谢存在异常,因此该患者脂肪变的原因考虑亦与代谢因素有关,是否与黄热病毒感染有关尚需研究。同时,提示对于黄热病患者在恢复期应注意加强生活方式教育,肝功能及肝超声等检查有必要监测1年以上,预防脂肪性肝炎的发生非常必要。
对黄热病患者T细胞亚群的动态监测,发现黄热病患者细胞免疫功能明显降低,重型病例更明显。本组两例重型病例的CD4+T淋巴细胞计数均低于200 cells/μL,提示严重细胞免疫功能缺陷,其中1例死亡,1例存活病例在恢复期虽然逐渐恢复,但至病程1年时仍未能恢复至正常范围,提示重型黄热病患者免疫功能完全恢复的时间较长。
本组病例除病例1因肾衰竭无尿,未能采集到尿标本进行核酸检测外,其他患者尿标本中病毒核酸均为阳性,尿核酸检测有利于诊断,同时尿液也是黄热病的潜在感染源。1例患者唾液中也检测到病毒核酸,提示在感染控制方面除注意蚊虫隔离外,也应重视体液隔离[14]。
黄热病的主要靶器官是肝和肾,但从本组病例看,中枢神经系统损伤也不可忽视,尤其重型病例。本组轻型患者腰穿结果正常,2例重型患者的腰穿检测结果均存在异常,提示合并中枢神经系统病变往往预示疾病预后不良。黄热病中枢神经细胞病变的主要表现为脑水肿,脑脊液压力升高,蛋白可以升高,但一般细胞数不高,脑组织病理改变主要是血管周围水肿和出血,而真正由于黄热病毒导致的病毒性脑炎非常罕见[1, 15]。值得注意的是黄热病疫苗除了目前常用的17D疫苗外,法国曾从小鼠脑组织分离到法国嗜神经疫苗,但因这种疫苗与较高的脑炎发生率有关而被停用,深度测序分析显示其神经系统副作用与遗传不稳定性有关[16],上述问题是否有潜在的关系仍需进一步研究。本组病例并未检测患者脑脊液中黄热病毒核酸,死亡病例也未进行尸检,中枢神经系统病变是否由病毒导致的直接损伤不得而知。临床中密切关注神经系统表现,及时给予对症支持治疗是提高救治成功的关键。
目前临床上无针对黄热病有特效的抗病毒药物,以对症支持治疗为主,早期有效的支持治疗是救治成功的关键。但近年来一些新型抗病毒药物可能有效,如法匹拉韦,是一种RNA依赖的RNA聚合酶抑制剂。研究[10, 17]表明,该药对流感病毒、黄热病毒、埃博拉病毒、拉萨热病毒等有效。在无有效抗病毒药物之前,提高对疾病的系统认识,及时阻断病情进展,仍是最重要的手段。在恢复期,需要警惕肝炎症复发,也需要警惕肝脂肪变,由于免疫功能未能完全恢复,也应注意预防感染。
虽然黄热病是致死性高的传染病,但是有针对该病的安全疫苗[18-19],可以终生免疫,最关键的防控措施是高危人群接种疫苗。我国尚无本土病例发生,所面临的黄热病疫情风险是由于经济全球化所带来的负效应。2016年本院与福州地区共收治的10例患者,仅2例曾经在发病前1~5年注射过黄热病疫苗,免疫失败的原因不清,但疫苗接种率低提高了感染风险。我国前往疫区人员的疫苗接种率不高,可能与疫苗供应、居民防范意识、担心疫苗副作用[20]等多种因素有关,但确需加强管理,以降低黄热病所致危害。
在2016年我国发生输入性黄热病疫情之后,至今未再报告新发输入性病例,也无本土病例报告。本次疫情的成功防控得益于早发现、早诊断、积极防控。我国在第一时间派出专家团队至安哥拉为我国务工人员补种黄热病疫苗[21],检疫检验及疾控部门提高防控意识,通过宣传百姓也获得了更多知识,相关人员做到主动报告和检验,积极采取各项综合措施,成功阻断了疫情的进一步扩散,但目前黄热病在非洲、美洲地区的疫情并未得到控制,我国仍有输入性疫情发生的风险,各方面工作不可松懈,仍需提高防控意识,提高对疾病临床规律的认识,从而能更好的应对疫情及提高救治水平。
| [1] |
Monath TP. (2001) Yellow fever:an update[J]. Lancet Infect Dis, 2001, 1(1): 11-20. DOI:10.1016/S1473-3099(01)00016-0 |
| [2] |
World Health Organization. Yellow fever-Angola[EB/OL]. (2019-02-12)[2019-02-16]. http://www.who.int/csr/don/12-february-2016-yellow-fever-angola/en.
|
| [3] |
Ling Y, Chen J, Huang Q, et al. Yellow fever in a worker returning to China from Angola, March 2016[J]. Emerg Infect Dis, 2016, 22(7): 1317-1318. DOI:10.3201/eid2207.160469 |
| [4] |
Song R, Guan S, Lee SS, et al. Late or lack of vaccination linked to importation of yellow fever from Angola to China[J]. Emerg Infect Dis, 2018, 24(7): 1383-1386. DOI:10.3201/eid2407.171868 |
| [5] |
Chen Z, Liu L, Lv Y, et al. A fatal yellow fever virus infection in China:description and lessons[J]. Emerg Microbes Infect, 2016, 5(7): e69. |
| [6] |
中华人民共和国国家卫生和计划生育委员会. 黄热病诊疗方案(2016年版)[J]. 传染病信息, 2016, 29(3): 125-128. |
| [7] |
Woodall JP, Yuill TM. Why is the yellow fever outbreak in Angola a 'threat to the entire world'?[J]. Int J Infect Dis, 2016, 48: 96-97. DOI:10.1016/j.ijid.2016.05.001 |
| [8] |
Ahmed QA, Memish ZA. Yellow fever from Angola and Congo:a storm gathers[J]. Trop Doct, 2017, 47(2): 92-96. DOI:10.1177/0049475517699726 |
| [9] |
王希, 徐伟丽. 1例黄热病疫苗引发的嗜内脏损害反应患者的护理[J]. 中华护理杂志, 2005, 40(11): 846-847. DOI:10.3321/j.issn:0254-1769.2005.11.021 |
| [10] |
王文政, 陈志海. 黄热病研究进展[J]. 国际病毒学杂志, 2017, 24(2): 137-141. |
| [11] |
Denis B, Chirio D, Ponscarme D, et al. Hepatitis rebound after infection with yellow fever virus[J]. Emerg Infect Dis, 2019, 25(6): 1248-1249. DOI:10.3201/eid2506.190069 |
| [12] |
施军平, 范建高, 武瑞, 等. 慢性乙型肝炎患者肝细胞脂肪变的发生率及其危险因素分析[J]. 中华肝脏病杂志, 2008, 16(7): 519-523. DOI:10.3321/j.issn:1007-3418.2008.07.010 |
| [13] |
刘景春, 郭春涛. 慢性丙型病毒性肝炎合并肝脂肪变的相关因素研究[J]. 海南医学, 2015, 26(7): 967-970. DOI:10.3969/j.issn.1003-6350.2015.07.0346 |
| [14] |
Li M, Wang B, Li L, et al. Rift valley fever virus and yellow fever virus in urine:a potential source of infection[J]. Virol Sin, 2019, 34(3): 342-345. DOI:10.1007/s12250-019-00096-2 |
| [15] |
Stevanson LD. Pathological changes in the central nervous system in yellow fever[J]. Arch Path, 1939, 27: 24-54. |
| [16] |
Beck AS, Wood TG, Widen SG, et al. Analysis by deep sequencing of discontinued neurotropic yellow fever vaccine strains[J]. Sci Rep, 2018, 8(1): 13408. DOI:10.1038/s41598-018-31085-2 |
| [17] |
Furuta Y, Gowen BB, Takahashi K, et al. Favipiravir(T-705), a novel viral RNA polymerase inhihitor[J]. Antiviral Res, 2013, 100(2): 446-454. DOI:10.1016/j.antiviral.2013.09.015 |
| [18] |
de Melo AB, da Silva Mda P, Magalhães MC, et al. Description of a prospective 17DD yellow fever vaccine cohort in Recife, Brazil[J]. Am J Trop Med Hyg, 2011, 85(4): 739-747. DOI:10.4269/ajtmh.2011.10-0496 |
| [19] |
Wieten RW, Jonker EF, van Leeuwen EM, et al. A single 17d yellow fever vaccination provides lifelong immunity; characte-rization of yellow-fever-specific neutralizing antibody and T-cell responses after vaccination[J]. PLoS One, 2016, 11(3): e0149871. DOI:10.1371/journal.pone.0149871 |
| [20] |
Barrett AD, Teuwen DE. "Yellow fever vaccine-how does it work and why do rare cases of serious adverse events take place?"[J]. Curr Opin Immunol, 2009, 21(3): 308-313. DOI:10.1016/j.coi.2009.05.018 |
| [21] |
国际在线.中国质检总局赴安哥拉防疫组为海外公民健康护航[EB/OL]. (2016-04-06)[2019-02-06]. http://news.cri.cn/201646/305bbfd9-d28b-ae81-7b5a-ccaea8b3a739.html.
|



