2. 江苏省疾病预防控制中心, 南京 江苏 210009
2. Jiangsu Provincial Center for Disease Prevention and Control, Nanjing 210009, China
鲍曼不动杆菌(Acinetobacter baumannii, AB)是导致医院感染的几种重要条件致病菌之一,尤其在重症监护病房(intensive care unit,ICU)。AB积累耐药机制的特性使其能快速对使用的抗菌药物产生耐药,且能在医院环境中存活长达数月,国内外均有AB医院感染流行和暴发的报道[1-2],本研究对江苏省某医院ICU患者及环境进行采样,从中分离AB并进行药敏试验及同源性分析,现将结果报告如下。
1 材料与方法 1.1 菌株来源从2016年6月1日—10月20日江苏省某医院ICU采集患者和环境标本180份,分离AB 41株,其中9株分离自患者,32株分离自医院环境及医务人员手。质控菌株为大肠埃细菌ATCC 25922,购自中国食品药品检定研究院。参考菌株为沙门菌H9812,由中国疾病预防控制中心传染病预防控制所赠送。
1.2 试剂Seakem Gold Agarose购自Lonza公司,Tris-HCl购自上海碧云天生物技术有限公司,EDTA购自北京索莱宝科技有限公司,TBE缓冲液购自上海生工,Gel Red购自Biotium公司,革兰阴性菌鉴定卡片及药敏卡片购自生物梅里埃公司,蛋白酶K、ApaⅠ酶、XbaⅠ酶购自宝生物工程有限公司。
1.3 仪器CHEF-DRⅢ、成像系统购自Bio-Rad公司,Bionumerics软件(Version No.4.5)购自Applied Maths公司,VITEK 2全自动微生物鉴定及药敏分析系统购自法国生物梅里埃公司。
1.4 菌株鉴定及药敏试验采用VITEK 2全自动微生物鉴定及药敏分析系统对菌株进行鉴定及药敏试验。药敏结果的判断按美国临床实验室标准化协会(CLSI)2013年版的标准,以敏感(S)、中介(I)、耐药(R)报告结果。多重耐药、泛耐药AB依据文献[3]进行判断。
1.5 脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)分型按照PulseNet Intenational《鲍曼不动杆菌脉冲场凝胶电泳标准操作程序》操作,AB选用ApaⅠ酶,H9812选用XbaⅠ酶。电泳条件为:起始转换时间为5 s,终止转换时间为20 s,电场角度为120°,电泳时间为18 h 45 min。电泳结束后将凝胶放入3×Gel Red染液中染色30 min,去离子水中洗脱10 min。Bio-Rad成像分析系统拍照。用BioNumerics软件对电泳图谱进行数据分析。
2 结果 2.1 病床分布该ICU共有病床27张,分布在大厅、单人间和双人间,其中1~12床分布于双人间,26、27床为单人间,其余床位均位于外部大厅。见图 1。
 |
| 图 1 ICU病床分布示意图 Figure 1 Distribution of ICU beds |
共采集ICU物体表面、医护人员手、湿化水及患者标本180份,经不动杆菌属筛选培养基筛选阳性60份,其中41份经VITEK 2全自动微生物鉴定药敏分析系统鉴定为AB。见表 1。
| 表 1 ICU环境、医务人员手及患者标本AB病原学检测结果 Table 1 Detection results of A. baumannii from environment, hands of health care workers and patient specimens in ICU |
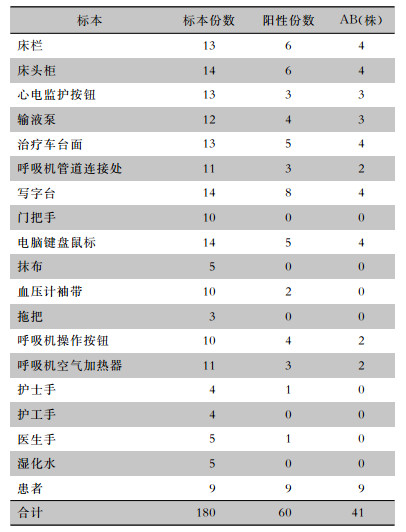
|
41株AB除对左氧氟沙星耐药率为34.1%外,对其他抗菌药物的耐药率均>70%。除对左氧氟沙星耐药率分别为37.5%、22.2%外,32株环境株、9株临床株AB对其他抗菌药物的耐药率均分别>65%、>88%。见表 2。41株AB中,34株为多重耐药菌,7株为泛耐药菌。其中环境AB菌株中,多重耐药菌25株,泛耐药菌7株;9株临床株均为多重耐药株。
| 表 2 AB对常用抗菌药物的耐药率(%) Table 2 Resistance rates of A. baumannii to commonly used antimicrobial agents(%) |
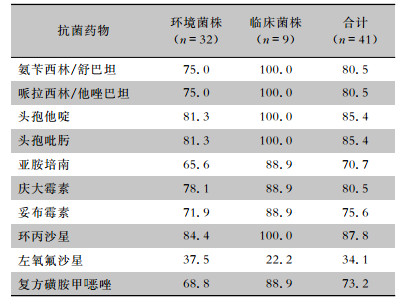
|
PFGE同源性分析,结果显示,41株AB分成19型,其中I、M、N、O、P 5个型别每型包含2株及以上,其余均为1株一型别。I型2株,来自于2床患者病房电脑及治疗车。M型2株,来自于18床患者写字台、治疗车。N型3株,来自于18床患者床栏、床头柜,心电监护仪。O型3株,均来自于患者的临床标本,分别为14、13、25床患者。最早入科的是14床患者,于2016年5月18日入科,6月6日检出AB,6月9日出科;13床患者于6月20日入科,6月21日痰标本中检出AB,确诊为AB医院感染。P型16株,其中有5株分别来自于25、14、15、24、8床患者,其余株来自于患者的呼吸机、治疗车以及周围环境。患者菌株中最早检出时间为2016年6月6日,环境中最早检出时间为2016年6月1日,由患者入科时间来判断,P型中25、15和8床患者为入科后发生的感染,均为医院感染,同时该型AB的检出时间从6月初跨至10月末(共141 d)。见表 3。同源性分析结果见图 2。
| 表 3 2016年6月1日—10月20日ICU 7例AB医院感染患者基本情况 Table 3 Basic conditions of 7 patients with A. baumannii infection in ICU from June 1 to October 20, 2016 |
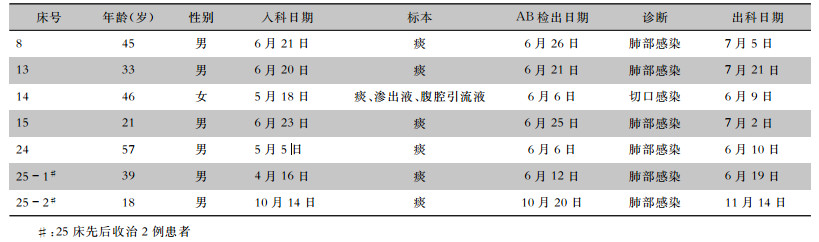
|
 |
| 图 2 41株AB PFGE分型结果 Figure 2 PFGE typing result of 41 strains of A. baumannii |
在不动杆菌属中,AB是引起医院感染最重要的细菌之一[4],由于AB在医院环境广泛存在,因此,在对医院ICU环境进行采样时,尽可能选择存在AB定植的物体表面,与研究[5-6]一致。采样数量较多的位置为床栏、床头柜、写字台、输液泵、心电监护按钮、治疗车台面、电脑键盘鼠标,床栏和床头柜是患者常接触的部位,其余均为医护人员常接触的部位,AB检出率较高,均超过20%。未从护士、医生的手检出AB。医务人员手的采样时机往往是采样的重点,尤其是处理一例患者到下一例患者之间非常关键,如未进行手卫生很有可能造成医院感染的传播。在实际采样操作过程中往往未能捕捉到此段时间,更有可能是在医护人员洗手后进行采样。
药敏分析结果显示,除对左氧氟沙星的耐药率为34.1%以外,AB对其他抗菌药物的耐药率均>70%。从多重耐药和泛耐药结果来看,所有泛耐药菌均来自环境,若清洁、消毒、隔离措施执行不到位则可能导致泛耐药AB传播,导致患者发生AB医院感染,给临床治疗带来难度。
同源性分析是对患者发生AB医院感染溯源调查的金标准,多项研究[7-11]均在不同的环境物体表面检出与患者同源的AB,但此类研究均无具体采样位置和采样时间,且未报道患者发生AB医院感染的的具体时间,不能清晰说明AB的传播方向及路径,也不能显示AB在同一环境中存在的时间长短,无法有力论证AB环境污染的危害。本研究详细记录了AB采样的时间、位置以及发生感染的患者的出入科时间,有助于分析AB的传播方向、传播范围及存在时间。从结果可以看出,AB在ICU分布广泛,病房家具、医疗器械均有定植,结合病房的床单元分布和本次的同源性分析结果发现,同源AB集中分布于大厅中的病床周围,且部分同源菌株检出时间跨度长达141 d,在此时间内,该基因型菌株一直存在于ICU环境中,对患者造成威胁。结合患者的入院时间、AB检出时间和PFGE图谱,可以确定有5例患者(14、24、15、25和8)发生P型AB医院感染。
揭示AB医院传播的目的是为了更好地控制医院感染。AB在该院传播范围广,相同PFGE型的AB在该院ICU存在时间跨度长。物体表面采样中无论是患者经常接触的床栏、床头柜,还是医护人员经常接触的医疗器械设施都有不同程度的污染,因此,物体表面的清洁消毒和医护人员、患者、清洁人员的手消毒应并重。本研究描述了江苏省某医院医院感染的部分情况,对医院ICU大多数环境物体表面进行采样,覆盖全面,但研究中的患者标本数目不多,由于条件限制未在患者发生感染后持续采样,无法追踪后续的病原体传播。且未对医护人员手进行医疗操作后及时采样,而医护人员手是病原体传播的重要媒介。本研究未提出具体的控制措施和评价方案,因此后续的工作应该着力于如何对环境及手进行有效、可行的消毒,优化清洁消毒程序,寻找合适的评价措施评估清洁消毒效果。
| [1] |
Guo-Xin M, Dan-Yang S, Xi-Zhou G, et al. Laboratory to clinical investigation of carbapenem resistant Acinetobacter baumannii outbreak in a general hospital[J]. Jundishapur J Microbiol, 2014, 7(1): e13120. |
| [2] |
Chang HL, Tang CH, Hsu YH, et al. Nosocomial outbreak of infection with multidrug-resistant Acinetobacter baumannii in a medical center in Taiwan[J]. Infect Control Hosp Epidemiol, 2009, 30(1): 34-38. DOI:10.1086/592704 |
| [3] |
李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64. DOI:10.3969/j.issn.1671-9638.2014.01.018 |
| [4] |
Lin MF, Lan CY. Antimicrobial resistance in Acinetobacter baumannii:From bench to bedside[J]. World J Clin Cases, 2014, 16, 2(12): 787-814. |
| [5] |
Chuang YY, Huang YC, Lin CH, et al. Epidemiological investigation after hospitalising a case with pandrug-resistant Acinetobacter baumannii infection[J]. J Hosp Infect, 2009, 72(1): 30-35. DOI:10.1016/j.jhin.2009.02.003 |
| [6] |
Gong Y, Shen X, Huang G, et al. Epidemiology and resis-tance features of Acinetobacter baumannii isolates from the ward environment and patients in the burn ICU of a Chinese hospital[J]. J Microbiol, 2016, 54(8): 551-558. |
| [7] |
Xia Y, Lu C, Zhao J, et al. A bronchofiberoscopy-associated outbreak of multidrug-resistant Acinetobacter baumannii in an intensive care unit in Beijing, China[J]. BMC Infect Dis, 2012, 12: 335. DOI:10.1186/1471-2334-12-335 |
| [8] |
Tjoa E, Moehario LH, Rukmana A, et al. Acinetobacter baumannii:Role in blood stream infection in Neonatal Unit, Dr. Cipto Mangunkusumo Hospital, Jakarta, Indonesia[J]. Int J Microbiol, 2013, 2013: 180763. |
| [9] |
Ye D, Shan J, Huang Y, et al. A gloves-associated outbreak of imipenem-resistant Acinetobacter baumannii in an intensive care unit in Guangdong, China[J]. BMC Infect Dis, 2015, 15: 179. DOI:10.1186/s12879-015-0917-9 |
| [10] |
Scott P, Deye G, Srinivasan A, et al. An outbreak of multidrug-resistant Acinetobacter baumannii-calcoaceticus complex infection in the US military health care system associated with military operations in Iraq[J]. Clin Infect Dis, 2007, 44(12): 1577-1584. DOI:10.1086/518170 |
| [11] |
Turton JF, Kaufmann ME, Warner M, et al. A prevalent, multiresistant clone of Acinetobacter baumannii in Southeast England[J]. J Hosp Infect, 2004, 58(3): 170-179. DOI:10.1016/j.jhin.2004.05.011 |




 唑
唑