2. 南方医科大学公共卫生与热带医学学院三级生物安全实验室, 广东 广州 510515
2. BSL-3 Laboratory of School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China
寨卡病毒(Zika virus, ZIKV)于1947年在乌干达寨卡丛林的恒河猴中发现,2007年在西太平洋密克罗尼西亚联邦的雅浦岛首次暴发流行,一直未得到广泛的关注。随着2015年巴西暴发大规模的婴儿小头畸形病例,ZIKV感染的潜在危害才引起全球重视。ZIKV对普通人群威胁不大,感染者可出现轻微发热或皮疹,部分感染者可能还会出现结膜炎、肌肉和关节痛以及疲劳感。孕妇感染后会干扰胎儿神经发育系统,可能导致胎儿流产、新生儿小头畸形,甚至死亡。同时,ZIKV还是格林-巴利综合征(guillainbarre syndrome,GBS)的一个触发因素[1-2]。ZIKV通过受感染的伊蚊属蚊虫叮咬传播,主要涉及热带地区的埃及伊蚊、白纹伊蚊等,此外还可通过性传播、母婴传播等。蚊子生存和繁殖环境扩大,同时受城市化与全球化影响,使ZIKV具有成为主要都市流行病的风险。研究[3-4]报道,ZIKV和登革病毒均主要由伊蚊传播,因此其可能沿登革病毒地理分布进行扩散。我国过去25年每年均有登革热病例报道,ZIKV也可能在我国流行,一旦流行将严重危害人口健康和社会经济发展。ZIKV感染传播迅速,但是目前的预防战略仅限于蚊虫控制,加强献血筛查血液供应保护措施等,因此,加快安全有效的疫苗研制至关重要[5]。近期已有美国研究者构建了表达ZIKV包膜蛋白(prM-Env)的DNA疫苗,并在小鼠模型检测到其具有很强的特异性体液免疫保护作用[6]。在预防性疫苗研究方面,已有病毒灭活疫苗、减毒活疫苗、DNA疫苗、病毒载体疫苗处于临床前或临床试验早期[7-9],但目前尚无疫苗投放市场[10]。重组腺病毒(recombinant adenovirus,rAd)作为目前最高效、可靠的重组病毒表达系统之一,已被广泛用于基因治疗和疫苗载体的各个领域。本研究利用成熟的商业化腺病毒AdMaxTM包装系统,将编码ZIKV包膜蛋白prM-E基因重组到E1缺失的复制缺陷型5型腺病毒(rAd5)载体上,诱导小鼠产生针对ZIKV的特异性细胞和体液免疫反应,为ZIKV候选疫苗的研制提供可靠的免疫原。
1 材料与方法 1.1 主要材料与试剂ZIKV毒株Z16006(GenBank:KU955589.1)病毒总RNA由南方医科大学公共卫生与热带医学学院三级生物安全实验室赵卫教授提供。PrimeScript Ⅱ High Fidelity RT-PCR Kit(Code No.R023A)(TaKaRa Biotechnology Ltd),引物由北京六合华大基因科技有限公司合成,DNA测序由上海英潍捷基贸易有限公司完成。pDC315和pBHGlox(delta)E1, 3Cre(哈尔滨兽医研究所马传染病与慢病毒病创新团队惠赠),Mouse IFN-γ ELISpot plus kit(Mabtech),Concanavalin A(Sigma,上海),ZIKV Env protein(Fitzgerald,cat.no.30-1932),寨卡E-56抗体(贝若凡生物科技有限公司,BF-1176-56),PE-Cy7小鼠荧光二抗(BD pharmingen),辣根过氧化酶HRP标记的山羊抗鼠IgG(北京博尔西生物科技有限公司)。
1.2 prM-E基因片段的分离与穿梭质粒载体的构建根据文献[11]报道的日本乙型脑炎病毒(JEV)信号肽氨基酸序列进行核苷酸编码,确定其碱基序列为5’-ATGGGCAAGAGGTCCGCTGGATCCATTATGTGGTTAGCATCCTTAGCTG-TCGTGATTGCATGTGCAGGCGCA-3’。设计两对引物F1、R1和F2、R2,其中F2序列过长分为F2-1和F2-2进行合成(表 1)。RT-PCR获得prM-E片段连接克隆载体pLB/prM-E与穿梭质粒pDC315,同时用EcoRI和BamHI双酶切,酶切得到片段prM-E和载体pDC315连接产物转化DH5α,获得重组穿梭质粒pDC315/prM-E,并测序鉴定,以间接免疫荧光法和Western blot方法检测表达情况。
| 表 1 prM-E扩增引物 Table 1 Amplification primers for prM-E |

|
6孔板内293A细胞融合度达80%时,在190 μLOpti-MEM中加入1 μg穿梭载体pDC315-prM-E和1 μg腺病毒骨架质粒Ad5 bone以及6 μL X-Treme,细胞内进行质粒同源重组。包装好的重组腺病毒rAd5/prM-E进行蚀斑筛选获得单一稳定的病毒株。空斑纯化后的病毒株感染293A细胞进行大量扩增,扩增所得病毒液用1.4 g/mL和1.2 g/mL的氯化铯以密度梯度离心法进行浓缩。
1.4 蛋白表达鉴定分别以pDC315空载体质粒和重组穿梭质粒pDC315-prM-E转染293A细胞,72 h后采用间接免疫荧光法检测表达产物中的ZIKV E蛋白:以寨卡E-56抗体孵育细胞,PE-Cy7小鼠荧光二抗染色后,荧光显微镜下观察是否有目的E蛋白表达。分别以包装、纯化及浓缩后重组病毒rAd5/prM-E感染293A细胞,72 h后收感染细胞表达产物(同时收集未感染的293A细胞裂解产物作为阴性对照),采用Western blot方法检测产物中是否有目的E蛋白表达:以寨卡E-56抗体反应(GAPDH作为内参),HRP标记的山羊抗鼠IgG孵育后,加底物显色,观察结果。
1.5 小鼠免疫接种5周龄,体重18~20 g的健康雌性C57BL/6小鼠20只,根据接种试剂不同分为3个组,其中实验组分为3个接种滴度,每个滴度5只小鼠,安慰剂组2只小鼠,阴性对照组3只小鼠。每只小鼠后肢大腿根部肌内注射100 μL溶剂,病毒接种剂量及接种方案见表 2。第0周初次免疫,第3周加强免疫,所有小鼠在第5周处理取材,取眼球血获得血清,取脾分离脾淋巴细胞。固相酶联免疫斑点技术(ELISpot)检测特异性T细胞反应,酶联免疫吸附试验(ELISA)检测免疫后小鼠血清抗体滴度。
| 表 2 小鼠免疫接种方案 Table 2 Mice vaccination regimens |
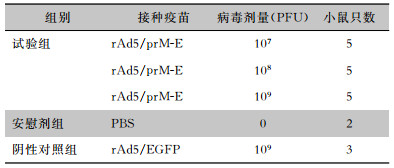
|
小鼠取脾分离淋巴细胞,IFN-γ ELISpot板每孔加入5×105个脾淋巴细胞,ELISpot方法检测特异性T细胞反应:ZIKV Env蛋白以终浓度10 μg/mL刺激细胞[分别以1640完全培养基和刀豆素(ConA)刺激作为阴性和阳性对照], 加入刺激物后ELISpot板于37℃,5%CO2恒温培养箱中静置培养36 h。培养结束后按照Mouse IFN-γ ELISpot plus kit(Mabtech)试剂盒说明书完成后续检测。ELISpot反应阳性判定标准:阳性刺激孔中有IFN-γ分泌,ZIKV Env蛋白刺激孔中每106脾淋巴细胞特异性斑点形成细胞数(SFCs)大于40,且大于三倍的阴性刺激孔斑点值。
1.7 血清ELISA实验小鼠眼球取血,分离血清。ELISA实验所需的重组寨卡病毒包膜糖蛋白(ZIKV rE)按照本实验室之前建立的方法在果蝇S2细胞中稳定表达获得[12]。ELISA板以7 μg/mL ZIKV rE蛋白在0.05 mol/L,pH=9.6碳酸盐溶液中于4℃冰箱包被过夜,以间接ELISA标准操作步骤完成后续检测。以PBS对照组的小鼠血清相应稀释度为基准,血清抗体滴度定义为OD值大于2倍基准值(S/CO>2)的最高稀释度的倒数,最终结果以血清抗体滴度的Log10值表示。
1.8 数据分析应用OriginPro 2017软件作图,应用SPSS 16.0软件对实验数据进行单因素方差分析(One-way ANOVA),结果以均数±标准差(x±s)表示,P≤0.05为差异具有统计学意义。
2 结果 2.1 目的基因的扩增及鉴定RT-PCR扩增产物经1%琼脂糖凝胶电泳,可见prM-E片段特异性目的条带,与预期2 001 bp相符(图 1A)。连接克隆载体的pLB/prM-E质粒经EcoRI和BamHI双酶切, 产物经琼脂糖凝胶电泳,在约2 974 bp处显示载体条带,在约2 001 bp可见特异性prM-E目的条带,与预期相符(图 1B),成功获得正确的目的基因片段prM-E。
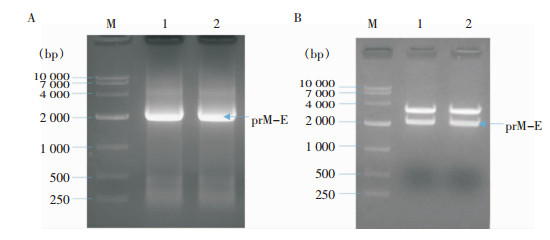 |
| M:10 000 bp DNA Marker;A:RT-PCR扩增产物电泳鉴定,1、2为prM-E RT-PCR扩增产物;B:克隆载体pLB/prM-E双酶切鉴定,1、2为pLB/prM-E双酶切产物 图 1 prM-E PCR扩增产物及鉴定电泳图谱 Figure 1 Electrophoresis map of PCR amplification and identification of prM-E |
RT-PCR扩增得到的prM-E基因前加入JEV信号肽和Kozak序列,获得的片段插入到穿梭载体pDC315中,构建重组穿梭质粒pDC315-prM-E示意图见图 2。穿梭质粒经EcoRI和BamHI双酶切后,产物经1%琼脂糖凝胶电泳,可见两条清晰的条带,在约3 913 bp处显示载体条带,在约2 000 bp可见特异性prM-E目的条带(图 3)。选取图 3中泳道2对应的质粒样品进行测序鉴定,结果正确,重组质粒构建成功。
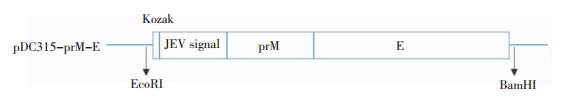 |
| 图 2 重组穿梭质粒pDC315-prM-E的结构示意图 Figure 2 Schematic diagram of recombinant shuttle -plamid pDC315-prM-E |
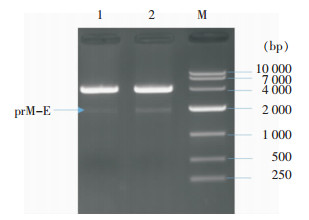 |
| M:10 000 bp DNA Marker;1、2为pDC315-prM-E双酶切产物 图 3 穿梭质粒pDC315-prM-E双酶切产物电泳图 Figure 3 Electrophoresis map of double-digestion product of shuttle -plasmid pDC315-prM-E |
间接免疫荧光法检测结果于荧光显微镜下观察,用绿色光源激发抗体孵育后的重组穿梭质粒pDC315-prM-E转染293A,可见特异性红色荧光,而pDC315空载体质粒转染293A的阴性对照组未见荧光。见图 4。
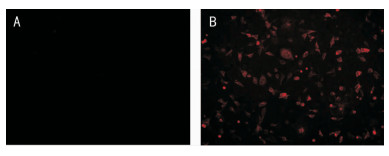 |
| A:pDC315空载体质粒转染293A细胞;B:pDC315/prM-E转染293A细胞 图 4 ZIKV E蛋白表达免疫荧光鉴定结果 Figure 4 Expression of ZIKV E protein identified by immunofluorescence |
Western blot方法鉴定结果可见,分别以包装、纯化及浓缩后重组病毒rAd5/prM-E感染293A细胞,表达产物均可见56 kDa的特异性ZIKV E蛋白目的条带,而293A裂解产物阴性对照未见特异性条带。见图 5。ZIKV E蛋白能够在重组病毒载体中正确、稳定表达。
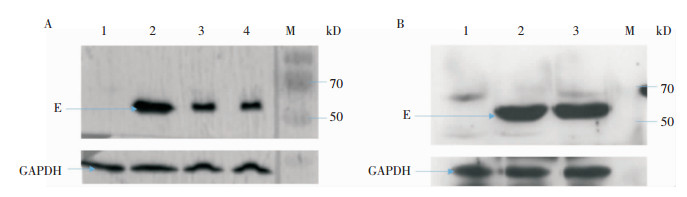 |
| A:包装及纯化后病毒表达鉴定,1为293A细胞,2为pDC315-prM-E单质粒转染293A细胞, 3为包装出的病毒rAd5/prM-E感染293A细胞,4为空斑纯化后病毒株感染293A细胞;B:浓缩后病毒表达鉴定,1为293A细胞,2和3为浓缩后病毒rAd5/prM-E感染293A细胞;M为10~140 kD蛋白Marker 图 5 ZIKV E蛋白表达Western blot鉴定结果 Figure 5 Expression of ZIKV E protein identified by Western blot |
采用ELISpot检测经ZIKV Env蛋白刺激的小鼠脾淋巴细胞分泌的特异性IFN-γ SFCs,将每106脾淋巴细胞中SFCs记为最终数值。不同剂量rAd5/prM-E免疫组结果分别为(688.54±186.43)、(1 084.90±144.14)和(1 640.20±147.13)SFCs/106脾淋巴细胞,与病毒剂量呈正比关系,且均高于接种109 PFU的rAd5/EGFP的对照组,差异具有统计学意义(P < 0.001)。重组病毒载体能够诱导小鼠产生强而有效的ZIKV特异性细胞免疫反应。见图 6。
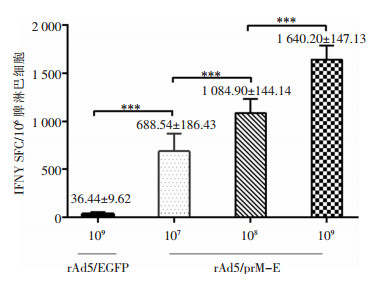 |
| ***:P < 0.001 图 6 免疫后小鼠细胞免疫反应检测结果 Figure 6 Detection result of cellular immune response in immunized mice |
不同剂量病毒免疫后小鼠的血清抗体滴度(以log10值表示)分别为(3.14±0.39)、(3.50±0.30)和(3.74±0.25)。随着病毒剂量的增高,小鼠血清抗体滴度具有增高趋势,且试验组小鼠血清抗体滴度均高于接种109 PFU的rAd5/EGFP对照组的小鼠,差异具有统计学意义(P < 0.001)。重组病毒载体能够有效诱导小鼠产生针对ZIKV E蛋白的特异性体液免疫。见图 7。
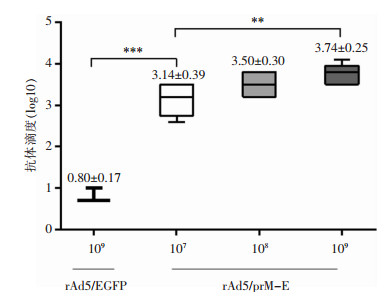 |
| **:P < 0.01,***:P < 0.001 图 7 免疫后小鼠体液免疫反应检测结果 Figure 7 Detection result of humoral immune response in immunized mice |
ZIKV对孕妇、旅行者以及公众的感染风险持续存在,其感染引发的新生儿小头症和先天畸形给患者及其家庭、社会带来沉重负担[4]。世界卫生组织于2016年2月1日宣布ZIKV成为全球紧急公共卫生事件。ZIKV疫苗有助于预防和控制ZIKV暴发流行。本研究成功获得一株高表达ZIKV包膜蛋白prM-E的腺病毒载体rAd5/prM-E,能够诱导小鼠产生强而有效的ZIKV特异性细胞和体液免疫反应,为ZIKV候选疫苗的研制积累了实验基础数据,提供了可靠的免疫原。
ZIKV是黄病毒科黄病毒属的单股正链RNA病毒,分为亚洲型和非洲型两个基因型,已有研究[13-14]表明,ZIKV的两种基因型相似性高达95%,仅代表一种血清型,感染或者接种一个ZIKV毒株可以引发针对所有ZIKV毒株的广泛中和抗体,因此一种疫苗抗原将对所有的ZIKV毒株产生保护。ZIKV包膜糖蛋白E与细胞受体相互作用介导病毒融合并进入靶细胞,是中和抗体的主要靶点,基于ZIKV prM-E蛋白的DNA疫苗在小鼠体内具有很强的特异性免疫保护作用[6, 15]。由于prM-E蛋白的单独表达需要在prM蛋白前加一段信号肽序列,故根据已有文献报道选择了来源于日本乙型脑炎病毒C末端的信号肽序列[16-17],同时在目的基因前加入Kozak序列用来增强真核表达。
rAd作为目前最高效可靠的重组病毒表达系统之一,已被广泛用于基因治疗和疫苗载体的各个领域。其中重组人血清5型腺病毒(rAd5)是诱导产生针对外源基因的特异性T细胞和B细胞免疫反应最强的腺病毒,是一个对目的蛋白在动物模型上进行免疫原性评价以及进行临床前评价阶段的理想载体。本研究利用成熟的商业化腺病毒AdMaxTM系统构建包装与表达ZIKV prM-E蛋白,获得高纯度、高滴度(2.18×1012 PFU/mL)的病毒载体疫苗。小鼠接种重组病毒载体疫苗后未见不良反应,体重和进食正常。为研究病毒载体疫苗接种剂量对免疫效果的影响,对不同免疫试验组进行比较,发现rAd5/prM-E免疫组小鼠抗原特异性IFN-γ分泌量与病毒接种剂量(107、108、109 PFU)呈正相关,血清抗体滴度随着病毒剂量的增加具有一定增高的趋势,且均高于对照组小鼠。综合以上结果,说明重组腺病毒载体疫苗rAd5/prM-E能够强烈有效地诱导小鼠产生针对ZIKV的特异性细胞和体液免疫反应。但是,临床试验表明,人体针对rAd5本身存在的十分普遍的预存免疫,会显著降低病毒载体在人体内的转导效率和转基因表达水平[18-19],针对此状况,最直接的方法是用其他种属外壳的人血清型腺病毒载体或直接应用非人类血清型的腺病毒载体,解决人群中预存Ad5中和抗体的问题[20-21]。故本课题组同时在构建基于黑猩猩腺病毒Sad23、Sad25和人类稀有型腺病毒Ad35和Ad49的新型腺病毒疫苗载体,结合本研究成果ZIKV-prM-E蛋白抗原基因,以期成功构建可用于临床的具有自主知识产权的ZIKV新型腺病毒载体疫苗。
| [1] |
Hajra A, Bandyopadhyay D, Hajra S. Zika virus:A global threat to humanity:A comprehensive review and current developments[J]. N Am J Med Sci, 2016, 8(3): 123-128. DOI:10.4103/1947-2714.179112 |
| [2] |
Plourde AR, Bloch EM. A literature review of Zika virus[J]. Emerg Infect Dis, 2016, 22(7): 1185-1192. DOI:10.3201/eid2207.151990 |
| [3] |
Fajardo Á, Cristina J, Moreno P. Emergence and spreading potential of Zika virus[J]. Front Microbiol, 2016, 7: 1667. |
| [4] |
Leonhard SE, Lant S, Jacobs BC, et al. Zika virus infection in the returning traveller:what every neurologist should know[J]. Pract Neurol, 2018, 18(4): 271-277. DOI:10.1136/practneurol-2017-001789 |
| [5] |
Marston HD, Lurie N, Borio LL, et al. Considerations for developing a Zika virus vaccine[J]. N Engl J Med, 2016, 375(13): 1209-1212. DOI:10.1056/NEJMp1607762 |
| [6] |
Larocca RA, Abbink P, Peron JP, et al. Vaccine protection against Zika virus from Brazil[J]. Nature, 2016, 536(7617): 474-478. DOI:10.1038/nature18952 |
| [7] |
Kim E, Erdos G, Huang S, et al. Preventative vaccines for Zika virus outbreak:preliminary evaluation[J]. EBioMedicine, 2016, 13: 315-320. DOI:10.1016/j.ebiom.2016.09.028 |
| [8] |
Pierson TC, Graham BS. Zika virus:immunity and vaccine development[J]. Cell, 2016, 167(3): 625-631. DOI:10.1016/j.cell.2016.09.020 |
| [9] |
McArthur MA. Zika virus:Recent advances towards the development of vaccines and therapeutics[J]. Viruses, 2017, 9(6): 143. DOI:10.3390/v9060143 |
| [10] |
[No authors listed]. WHO and experts prioritize vaccines, diagnostics and innovative vector control tools for Zika R&D[J]. Saudi Med J, 2016, 37(4): 471-472. https://www.who.int/news-room/detail/09-03-2016-who-and-experts-prioritize-vaccines-diagnostics-and-innovative-vector-control-tools-for-zika-r-d
|
| [11] |
Davis BS, Chang GJ, Cropp B, et al. West Nile virus recombinant DNA vaccine protects mouse and horse from virus challenge and expresses in vitro a noninfectious recombinant antigen that can be used in enzyme-linked immunosorbent assays[J]. J Virol, 2001, 75(9): 4040-4047. DOI:10.1128/JVI.75.9.4040-4047.2001 |
| [12] |
边奕鑫, 何作萍, 杜鹏, 等. HCV结构蛋白E2在果蝇S2细胞中的稳定表达[J]. 中国输血杂志, 2013, 26(10): 972-975. |
| [13] |
Dowd KA, Demaso CR, Pelc RS, et al. Broadly neutralizing activity of Zika virus-immune sera identifies a single viral serotype[J]. Cell Rep, 2016, 16(6): 1485-1491. DOI:10.1016/j.celrep.2016.07.049 |
| [14] |
林垚, 文送娇, 洪珊, 等. 寨卡病毒亚洲型与非洲型基因同源性及重组分析[J]. 中国生物制品学杂志, 2018, 31(12): 1317-1321. |
| [15] |
Qadir A, Riaz M, Saeed M, et al. Potential targets for therapeutic intervention and structure based vaccine design against Zika virus[J]. Eur J Med Chem, 2018, 156: 444-460. DOI:10.1016/j.ejmech.2018.07.014 |
| [16] |
Chang GJ, Hunt AR, Davis B. A single intramuscular injection of recombinant plasmid DNA induces protective immunity and prevents Japanese encephalitis in mice[J]. J Virol, 2000, 74(9): 4244-4252. DOI:10.1128/JVI.74.9.4244-4252.2000 |
| [17] |
卢昌, 李娜, 薛璞, 等. 寨卡病毒包膜prM-E蛋白的结构和功能分析[J]. 中国人兽共患病学报, 2017, 31(1): 81-84. DOI:10.3969/j.issn.1002-2694.2017.01.015 |
| [18] |
柳云帆, 吴小兵, 阮力. 腺病毒载体在疫苗研究中的应用[J]. 生物技术通讯, 2011, 22(4): 552-558. DOI:10.3969/j.issn.1009-0002.2011.04.023 |
| [19] |
Bradley RR, Lynch DM, Iampietro MJ, et al. Adenovirus serotype 5 neutralizing antibodies target both hexon and fiber following vaccination and natural infection[J]. J Virol, 2012, 86(1): 625-629. DOI:10.1128/JVI.06254-11 |
| [20] |
于彬, 孔维, 于湘晖, 等.逃避预存免疫的重组腺病毒及其构建方法和用途[P]. 2015-03-18.
|
| [21] |
Xu K, Song Y, Dai L, et al. Recombinant chimpanzee adenovirus vaccine AdC7-M/E protects against Zika virus infection and testis damage[J]. J Virol, 2018, 92(6), pii: e01722-17. https://www.x-mol.com/paper/579895
|



