非结核分枝杆菌(nontuberculous Mycobacterium, NTM)在土壤、水、尘土等自然环境中广泛存在,可导致肺部感染、淋巴结炎、皮肤和软组织感染等。一般为单发,少数可以多发或多个系统被累及,凡全身有2处以上的病灶或血液中发现该菌者称为播散性非结核分枝杆菌病(disseminated nontuberculous mycobacterial disease, DNTMD)[1]。DNTMD罕见,且根据国内外报道,DNTMD主要为机会感染,多见于有明显免疫缺陷者,如艾滋病晚期、毛细胞性白血病、服用免疫抑制剂等患者,也有极少数健康人反复感染NTM,出现以呼吸系统为主的症状[2]。根据Runyon分类法,偶发分枝杆菌属于非结核分枝杆菌分类中的Ⅳ组,即快速生长分枝杆菌,接种在培养基上3~5 d内有肉眼可见的菌落,多数在1周内即生长旺盛。在一般情况下, 此类细菌可从尘埃、土壤、水或正常人的唾液、痰中分离出来,其致病力弱, 为条件致病菌,只有当局部或全身抵抗力降低时, 存在于机体内外的分枝杆菌才可繁殖致病。主要通过破损皮肤处或创口感染人体, 经过数周后形成局限性硬结、溃疡、脓肿。目前,国内关于播散性偶发分枝杆菌病的报道甚少[3-4],而健康人患播散性偶发分枝杆菌病更是罕见。本文报道1例累及多系统的健康成年人播散性偶发分枝杆菌感染,并复习文献以提高对该病的认识,为治疗及预后的评估提供参考。
1 病历资料患者女性,25岁,学生,因“反复颈部淋巴结大5个月,发热4个月”于2017年11月23日入院。患者既往身体健康,于2017年6月20日无明显诱因出现右颌下淋巴结大,约0.5 cm×0.5 cm大小,后逐渐变大约1 cm×1 cm,无明显压痛。7月9日开始反复出现发热,体温升高时颈部淋巴结肿大明显,出现双踝关节皮下结节伴踝关节肿痛,曾于外院行右颌下淋巴结活检,考虑淋巴结慢性肉芽肿性炎,组织培养未见阳性结果。肺部CT提示,右肺上叶尖段密度增高影,右肺门、纵隔多发肿大淋巴结,考虑肺结核。8月10日开始抗结核治疗(异烟肼+利福平),用药后有恶心感及皮疹加重倾向,8月15日左右停用。停药后仍有反复高热,咳嗽、咳痰,就诊于外院,CT仍提示多发淋巴结及肺部病变,淋巴结活检示化脓性坏死性淋巴结炎,未见真菌,特殊染色PAS及D-PAS未见特殊病原菌。外周血马尔尼菲蓝状菌载量分子检测6.17×103 copies/mL,当地医院疑诊“播散性马尔尼菲青霉菌病”。11月6日开始使用两性霉素B抗真菌治疔,后体温逐渐正常,颈部淋巴结缩小, 11月20日开始口服伊曲康唑口服液抗真菌治疗,发热有缓解,但右颈部淋巴结大仍未缓解。
体格检查:体温36.6℃,脉搏105次/分,呼吸18次/分,血压111/78 mmHg。右颈部淋巴结可触及多个淋巴结大,较大者1.5 cm×1 cm,有轻压痛,质地中等,与周围组织无明显黏连。双侧踝关节可见皮下结节,局部皮温升高,红肿疼痛,头面部可见多数绿豆大小红色丘疹、水肿性红斑,躯干、四肢散在分布黄豆大小红斑,部分呈靶形。
检查结果:血常规白细胞计数19.4×109/L,血红蛋白100 g/L,血小板计数474×1012/L,中性粒细胞百分比73.3%。C反应蛋白(CRP) 27.82 mg/L,血沉(ESR) 78 mm/h。结核抗体IgG阳性,T细胞斑点试验(T-SPOT):阴性;G试验:阴性,GM试验:0.568(阳性>0.5);免疫全套:补体C4 0.42 g/L,免疫球蛋白G 31.97 g/L。狼疮全套、ASO、RF、ANA谱、血管炎三项、ANCA阴性。痰抗酸染色:阴性。浅表淋巴结彩超:右侧颈部、腋窝、腹股沟区多发低回声团,左侧腋窝、腹股沟区多发低回声团,考虑肿大淋巴结。CT:右肺门肿块灶并纵隔、右肺门及右颈部多发淋巴结大(见图 1)。PET-CT:考虑右肺癌并右肺内、右侧肺门、纵隔、右侧锁骨上窝、右侧颈部及肝门区多发淋巴结转移(见图 2)。支气管检查提示呈现支气管炎症改变。EBUS-TBNA未见恶性细胞, 抗酸染色阴性,PAS染色阴性。淋巴结活检组织病理:淋巴结肉芽肿性炎,免疫组化提示CK(-)、CD68(+),形态上考虑淋巴结结核病可能性大,抗酸染色未找到阳性菌。皮肤活检病理:皮肤浅深层血管周围灶状中性粒细胞、淋巴细胞浸润,皮下脂肪小叶间隔血管周围中性粒细胞、嗜酸性粒细胞及淋巴细胞结节状浸润,红细胞外溢。PAS阴性,免疫组化:全T细胞(+),全B细胞(-)。IgG、IgA、IgM、C3、C1q均阴性。
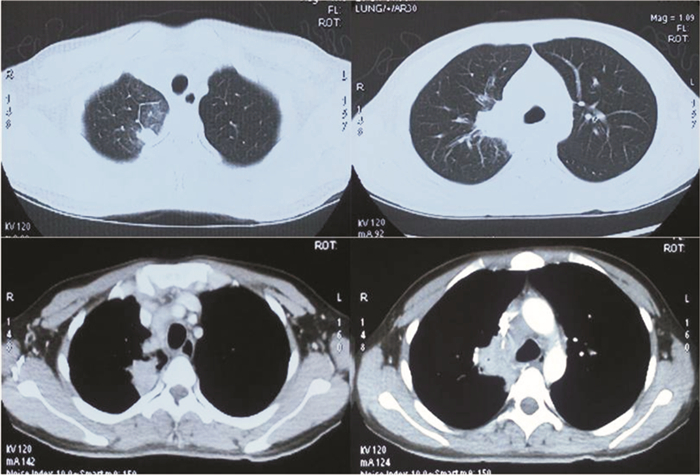 |
| 图 1 全身播散性偶发分枝杆菌病患者肺部CT影像图 Figure 1 Pulmonary CT image of patients with systemic disseminated M. fortuitum disease |
 |
| 右肺多发葡萄糖代谢增高结节 图 2 全身播散性偶发分枝杆菌病患者PET-CT影像图 Figure 2 PET-CT image of patients with systemic disseminated M. fortuitum disease |
患者入院后血常规提示白细胞明显增高,再次出现发热、皮损,颈部淋巴结大加剧,予头孢西丁+多西环素抗感染,效果不佳,2017年11月28日再次行淋巴结活检,2017年12月6日培养结果:速生型结核分枝杆菌,暂未具体分型,改克拉霉素+左氧氟沙星+利奈唑胺抗感染,12月7日患者皮疹消退,12月9日培养结果示偶发型分枝杆菌,继续原方案,2017年12月14开始体温正常,病情稳定。出院诊断:偶发型分枝杆菌感染(肺部、淋巴结、皮肤、关节)。诊断依据:患者有肺部、淋巴结、皮肤、关节病变,淋巴结可见典型肉芽肿性病变,且组织培养为偶发型分枝杆菌阳性,抗非结核分枝杆菌治疗有效。
2018年3月11日胸部CT提示,右肺上叶软组织密度灶较前明显缩小,测量数值为2.8 cm×2.5 cm×5.7 cm(2018年2月1日病灶大小为3.4 cm×3.9 cm×8.2 cm)。ERS 14 mm/h,血小板327×1012/L,白细胞计数8.95×109/L,血红蛋白134 g/L。
2 讨论 2.1 概述近年来,NTM病的发病率及患病率在一些国家及地区呈增加趋势[5]。我国历次结核病流行病学调查资料显示,NTM分离率从1990年的4.9%升至2000年的11.1%,2010年为22.9%,反映出我国NTM呈上升态势[6]。大多数DNTMD患者合并有基础疾病,如人类免疫缺陷病毒(HIV)感染,服用免疫抑制剂等。引起播散性病变的主要菌种有鸟-胞内分枝杆菌复合菌组、脓肿分枝杆菌、嗜血分枝杆菌等,次要菌种有偶发分枝杆菌、蟾分枝杆菌、龟分枝杆菌、海分枝杆菌等。DNTMD最常见的症状为不明原因、持续性或间歇性发热,多有进行性的体重减轻、夜间盗汗,胃肠道症状有轻度腹痛甚至持续性腹痛,不易缓解的腹泻和消化不良等;不少患者可有腹部压痛及肝脾大等体征,部分患者可有皮下多发性结节或脓肿。
2.2 发病机制目前研究认为,宿主的免疫缺陷是导致NTM发病的主要机制。CD4+T细胞等介导的免疫反应和迟发型变态反应,通过分泌IFN-γ、IL-12等细胞因子,介导中性粒细胞及巨噬细胞杀灭NTM。HIV感染者体内CD4+T细胞减少,容易发生机会感染,可发展为DNTMD。而健康人发生DNTMD则与IFN-γ/IL-12合成及反应通路中某些基因突变有关,其中GATA2的缺乏和IFN-γ自身抗体的存在导致机体IL-12、IFN-γ不足,是导致健康成人DNTMD发生的主要原因[2, 7]。
2.3 病理变化DNTMD可侵犯全身脏器,最常受累的器官是肝、淋巴结、肺、胃肠道,骨髓、心和肾也可累及。其中淋巴结病的病理早期以淋巴细胞、类上皮细胞、朗格汉斯细胞为主的肉芽肿为特征,后期累及的淋巴结黏连成串、肿大、质韧,可形成纤维化、钙化,也可迅速干酪样坏死及软化、破溃形成慢性窦道。皮肤病变最易侵犯真皮和皮下脂肪组织,病变早期为急性炎症反应和渗出,病理改变包括渗出、增生和坏死性病变,随后可见硬结、脓肿和窦道形成。新旧病灶常在同一病例交替存在,其主要病理表现为肉芽肿性病变和非特异性慢性化脓性炎症。本例患者淋巴结活检可见典型肉芽肿性炎症,皮肤活检以血管周围中性粒细胞、淋巴细胞浸润为主,提示皮肤急性期炎症反应[8]。
2.4 诊断DNTMD诊断主要参照2012年《非结核分枝杆菌病诊断与处理指南》中的标准:具有相关的临床症状,经相关检查发现有肺或肺外组织与器官病变,血培养NTM阳性,和(或)骨髓、肝、胸腔内或腹腔内淋巴结穿刺物培养NTM阳性。该例患者有肺部、淋巴结、皮肤、关节病变,淋巴结可见典型肉芽肿性病变,且组织培养为偶发型分枝杆菌,故诊断明确。
NTM肺病的肺部CT表现以实变、空洞、纤维索条影为最常见,而偶发分枝杆菌常出现以一侧或两侧肺实变影为主的改变[9]。研究显示,采用荧光定量PCR检测病变组织中的分枝杆菌, 对结核/非结核分枝杆菌分类有效, 阳性率高于特殊染色(抗酸、金胺O染色), 为临床诊治提供可靠依据[10]。此外,T-SPOT通过酶联免疫斑点检测法,检测外周血肽类抗原6 ku早期分泌靶向抗原(early secreting antigen target 6,ESAT-6)和10 ku培养滤过蛋白(culture filtrate protein 10,CFP-10)刺激后释放干扰素的T细胞,有助于早期鉴别结核分枝杆菌与多数NTM感染。ESAT-6与CFP-10均位于结核分枝杆菌上称为region of difference(RD1)的特定基因组区域,而RD1存在于结核分枝杆菌复合群中,以及极少数非结核分枝杆菌属中(如海分枝杆菌、堪萨斯分枝杆菌等),感染以上分枝杆菌者可导致T-SPOT试验阳性。而在卡介苗及大多数NTM中,不存在RD1,检测结果为阴性。因此,研究认为,T-SPOT法对于结核分枝杆菌与NTM感染的早期鉴别诊断,尤其是肺部分枝杆菌感染病例中,诊断灵敏度、特异度高,具有优良的鉴别诊断价值[11]。
体内抗IFN-γ自身抗体浓度的测定以及GATA2序列的检测可以进一步明确患者是否存在IFN-γ/IL-12合成与反应通路异常而导致其宿主易感性提高[12],但目前国内无商品化的试剂盒,费用昂贵,存在局限性。
本例患者外院检查血液中马尔尼菲蓝状菌载量较高,但组织或血液培养均无阳性结果,多次淋巴结活检未见确诊依据,外院予抗真菌治疗体温下降过程为一过性,其余临床特征如颈部淋巴结、皮损、血常规、影像学等均无改善。入院后淋巴结活检组织培养结果为偶发分枝杆菌,即停用抗真菌治疗。临床观察3个月,针对偶发分枝杆菌治疗效果显著,故排除马尔尼菲蓝状菌感染。
2.5 治疗及预后目前,尚无特效治疗NTM肺病的化学药物和标准的化学治疗方案,且多数NTM对抗结核药物耐药。根据2007年美国胸科学会和美国传染病学会的建议,倾向于应用大环内酯类抗生素,联合抗结核药治疗[13]。2012年《非结核分枝杆菌病诊断与治疗专家共识》中主张尽可能根据药敏试验结果及用药史,选择5~6种药物联合治疗,强化期6~12个月,巩固期12~18个月,在NTM培养结果转阴后继续治疗12个月以上。偶发分枝杆菌皮肤、软组织和骨病的推荐治疗方案:根据体外药敏试验结果,至少采用2种敏感药物,如喹诺酮类、利福平或利福布汀和克拉霉素或阿米卡星,疗程至少4个月,骨病患者的疗程至少6个月,对于病灶广泛、脓肿形成及药物疗效不佳者,可采用外科清创术或异物清除处理。偶发分枝杆菌肺病的推荐治疗方案:克拉霉素加1种敏感药物,疗程至痰培养结果阴转后12个月。与缓慢生长的分枝杆菌的治疗不同,快速生长分枝杆菌对一线抗结核药物具有耐药性,但易受其他多种抗菌药物(如大环内酯类、喹诺酮类、头孢菌素、四环素类、磺胺甲
结合偶发型分枝杆菌的感染特点,在治疗时需注意以下几个重要问题。首先,避免采用单一药物治疗严重感染,因为细菌存在通过目标突变获得耐药的可能性或者诱导性耐药机制(如外排泵的甲基化酶)的存在。推荐联合使用大环内酯类药物或者喹诺酮类药物,外加注射用抗菌药物(阿米卡星对速生型分枝杆菌效果一致,而头孢西丁和亚胺培南抗菌活性较低)。对于少量细菌引起的毛囊炎、皮肤及软组织轻度感染,可采用单药治疗[19]。其次,在植入人工异物(如人工瓣膜、起搏器、矫形假体、导尿管等)的情况下,需要在感染控制之后移除异物[19]。第三,抗感染治疗的时间取决于感染的性质。对于严重的骨感染,建议至少6个月以上的治疗,轻度感染可以在短时间内治疗成功[20]。
对于部分存在IFN-γ自身抗体或其他免疫疾病的DNTMD患者,国外有应用免疫调节、利妥昔单抗、IFN-γ、静注免疫球蛋白、血浆置换、环磷酰胺等治疗方式的病例[12]。即使做了很多有益探索,但目前DNTMD预后仍较差,病死率较高。本例患者予克拉霉素+左氧氟沙星+利奈唑胺治疗,1周左右体温恢复正常,皮疹消退,白细胞较前下降。3个月后患者病情稳定,复查肺部CT提示肺部结节缩小,血常规正常。
| [1] |
McCarthy KD, Cain KP, Winthrop KL, et al. Nontuberculous mycobacterial disease in patients with HIV in Southeast Asia[J]. Am J Respir Crit Care Med, 2012, 185(9): 981-988. DOI:10.1164/rccm.201107-1327OC |
| [2] |
Wu UI, Holland SM. Host susceptibility to non-tuberculous mycobacterial infections[J]. Lancet Infect Dis, 2015, 15(8): 968-980. DOI:10.1016/S1473-3099(15)00089-4 |
| [3] |
吴武佳, 李庆华, 马晓光, 等. 从血液中分离出一株偶发分枝杆菌[J]. 临床肺科杂志, 2015, 20(4): 752-754. DOI:10.3969/j.issn.1009-6663.2015.04.057 |
| [4] |
侯晓娜, 苏跃新, 胡月芬, 等. 偶发分枝杆菌败血症一例[J]. 中华检验医学杂志, 1994, 17(5): 315. DOI:10.3760/j:issn:1009-9158.1994.05.003 |
| [5] |
Thomson RM. Changing epidemiology of pulmonary nontuberculous mycobacteria infections[J]. Emerg Infect Dis, 2010, 16(10): 1576-1583. DOI:10.3201/eid1610.091201 |
| [6] |
王宇. 全国第五次结核病流行病学抽样调查资料汇编[M]. 北京: 军事医学科学出版社, 2011.
|
| [7] |
Chan ED, Bai X, Kartalija M, et al. Host immune response to rapidly growing mycobacteria, an emerging cause of chronic lung disease[J]. Am J Respir Cell Mol Biol, 2010, 43(4): 387-393. DOI:10.1165/rcmb.2009-0276TR |
| [8] |
中华医学会结核病学分会, 《中华结核和呼吸杂志》编辑委员会. 非结核分枝杆菌病诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2012, 35(8): 572-580. DOI:10.3760/cma.j.issn.1001-0939.2012.08.006 |
| [9] |
贺伟, 潘纪戍, 周新华. 非结核分枝杆菌肺病的影像学表现[J]. 中华结核和呼吸杂志, 2004, 27(8): 553-556. DOI:10.3760/j:issn:1001-0939.2004.08.024 |
| [10] |
王旭洲, 谢飞来, 郑智勇. 荧光定量PCR检测结核/非结核分枝杆菌在肉芽肿病理诊断中的应用[J]. 临床与实验病理学杂志, 2013, 29(8): 884-887. DOI:10.3969/j.issn.1001-7399.2013.08.016 |
| [11] |
姚雨濛, 潘珏, 高晓东, 等. T细胞斑点试验对活动性结核与非结核分枝杆菌感染的鉴别诊断价值[J]. 中华医院感染学杂志, 2017, 27(12): 2683-2685. |
| [12] |
Valour F, Perpoint T, Sénéchal A, et al. Interferon-γ autoantibodies as predisposing factor for nontuberculous Mycobacterial infection[J]. Emerg Infect Dis, 2016, 22(6): 1124-1126. DOI:10.3201/eid2206.151860 |
| [13] |
Griffith DE, Aksamit T, Brownelliott BA, et al. An official ATS/IDSA statement:diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases[J]. Am J Respir Crit Care Med, 2007, 175(4): 367-416. DOI:10.1164/rccm.200604-571ST |
| [14] |
van Ingen J, Ferro BE, Hoefsloot W, et al. Drug treatment of pulmonary nontuberculous mycobacterial disease in HIV-negative patients:the evidence[J]. Expert Rev Anti Infect Ther, 2013, 11(10): 1065-1077. DOI:10.1586/14787210.2013.830413 |
| [15] |
National Committee for Clinical Laboratory Standards (NCCLS). Susceptibility testing of Mycobacteria, Nocardia, and other aerobic Actynomycetes; Approved standard. M24-A, 2003[EB/OL]. (2013-04)[2018-03]. http://demo.nextlab.ir/Organization/Documents/CLSI-Standards/CLSI-M24-A.aspx.
|
| [16] |
Nash KA, Zhang Y, Brown-Elliott BA, et al. Molecular basis of intrinsic macrolide resistance in clinical isolates of Mycobacterium fortuitum[J]. J Antimicrob Chemother, 2005, 55(2): 170-177. DOI:10.1093/jac/dkh523 |
| [17] |
Schembri S, Williamson PA, Short PM, et al. Cardiovascular events after clarithromycin use in lower respiratory tract infections:analysis of two prospective cohort studies[J]. BMJ, 2013, 346: f1235. DOI:10.1136/bmj.f1235 |
| [18] |
Phadke VK, Hirsh DS, Goswami ND. Patient report and review of rapidly growing Mycobacterial infection after cardiac device implantation[J]. Emerg Infect Dis, 2016, 22(3): 389-395. DOI:10.3201/eid2203.150584 |
| [19] |
Esteban J, Ortiz-Pérez A. Current treatment of atypical mycobacteriosis[J]. Expert Opin Pharmacother, 2009, 10(17): 2787-2799. DOI:10.1517/14656560903369363 |
| [20] |
De Groote MA, Huitt G. Infections due to rapidly growing Mycobacteria[J]. Clin Infect Dis, 2006, 42(12): 1756-1763. DOI:10.1086/504381 |



