2. 苏州大学附属第一医院肿瘤科, 江苏 苏州 215006
2. Department of Oncology, the First Affiliated Hospital of Soochow University, Suzhou 215006, China
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是目前治疗一系列血液疾病的有效手段之一,通过重建血液病患者正常的造血功能和免疫状态,从而达到治愈疾病的目的[1-2]。由于疾病本身及后续的治疗,包括移植预处理方案所用化学治疗药物及预防移植抗宿主病(graft-versus-host disease,GVHD)使用的免疫抑制药物,使患者的免疫防线进一步丧失。患者行HSCT之前需进行大剂量的化学治疗,长期静脉输注治疗药物、血制品及肠外营养。中心静脉导管的置入,尤其是现阶段经外周静脉中心静脉置管(peripherally inserted central venous catheter,PICC)使用广泛,微生物容易在导管内壁定植,甚至形成生物膜[3],使得血液病患者发生中心静脉导管相关血流感染(central line-associated bloodstream infection,CLABSI)的风险增加。而移植患者的血流感染除可由外源性病原体引起外,也可由黏膜炎及GVHD引起的黏膜屏障破坏而导致的胃肠道和皮肤正常菌群入血而引起[4]。
美国疾病控制与预防中心(CDC)/国家医疗卫生安全网络(NHSN)将CLABSI定义为中央导管呈留置状态或当天拔除中央导管或前一日已拔除中央导管的患者发生的、有实验室病原学证据的血流感染[5]。此定义中包含了与导管置入无关的病原菌,如肠道内革兰阴性芽孢杆菌及草绿色链球菌,这些病原菌更可能通过受损的黏膜屏障进入血流引起感染。因此,我们重新定义了校正CLABSI(modified central line-associated bloodstream infection, MCLABSI),排除了传统CLABSI(original central line-associated bloodstream infection, OCLABSI)中经实验室证明的黏膜屏障破坏引起的血流感染(mucosal barrier injury laboratory-confirmed bloodstream infection,MBI-LCBI)[6]。
如何降低移植患者导管相关血流感染发病率,从而提高移植疗效仍然是研究者们不断探索的方向。本研究分析了OCLABSI的病原菌分布及危险因素,为HSCT患者CLABSI的预防和抗菌药物合理选择提供依据。
1 对象与方法 1.1 研究对象2016年11月1日—2017年10月30日于苏州大学附属第一医院血液科行HSCT的急性髓系白血病(acute myeloid leukemia,AML)和骨髓增生异常综合征(myelodysplastic syndrome,MDS)患者。收集患者的年龄、性别、置管日数、移植细胞类型、所患血液肿瘤的类型、预处理方案、GVHD预防方案等资料。
1.2 诊断标准 1.2.1 OCLABSI中央导管呈留置状态或当天拔除中央导管或前一日已拔除中央导管的患者,首次满足以下标准之一时诊断为CLABSI。标准1:至少1套或1套以上的血培养分离出公认的病原菌,且与其他部位的感染无关。公认病原菌包括:金黄色葡萄球菌、肠球菌属、大肠埃希菌、假单胞菌属、克雷伯菌属、假丝酵母菌属等。标准2:同时满足以下条件,(1)不同时段抽取的2套或多套血培养,所分离出的微生物为常见皮肤共生菌;(2)患者至少有以下一种症状或体征:发热(体温 > 38℃)、寒战;(3)症状和体征及阳性实验室结果与其他部位的感染无关。标准3:同时满足以下条件,(1)不同时段抽血的2套或多套血培养,所分离出的微生物为常见皮肤共生菌;(2)≤1岁的婴儿至少具有以下症状或体征之一:发热(体温 > 38℃)、低体温(肛温 < 36℃)、呼吸暂停、心动过缓;(3)症状和体征及阳性实验室结果与其他部位的感染无关。
1.2.2 MCLABSI满足OCLABSI的诊断标准,排除以下患者:(1)血培养结果为草绿色链球菌的口腔黏膜炎患者;(2)血培养结果为肠球菌属、肠杆菌科细菌、假丝酵母菌属的中性粒细胞减少或肠道有GVHD表现的患者。
1.3 菌株鉴定及药敏试验菌株采用法国梅里埃生物公司VITEK-32自动鉴定系统进行鉴定,药敏试验采用纸片扩散法(K-B法),药敏纸片购自英国Oxiod公司,试验方法和结果判读按美国临床实验室标准化协会(CLSI)推荐方法和标准进行。
1.4 质控菌株大肠埃希菌ATCC 29522、肺炎克雷伯菌ATCC 700603、铜绿假单胞菌ATCC 27853和金黄色葡萄球菌ATCC 25923,由卫生部临床检验中心提供。
1.5 统计学分析应用SPSS 22.0软件对数据进行分析,计数资料以率表示,非正态分布计量资料以M(P25,P75)表示,危险因素分析采用多因素Cox回归检验,P≤0.05为差异具有统计学意义。
2 结果 2.1 基本情况2016年11月1日—2017年10月30日于苏州大学附属第一医院血液科行HSCT的AML和MDS患者共218例,其中AML患者161例(73.9%),MDS患者57例(26.1%)。男性111例(50.9%),女性107例(49.1%)。年龄8~65岁,平均年龄36.3岁。患者确诊至移植的时间为8.7(0.7~183.1)个月。PICC留置时间为140.5(27~1 005)d。预处理后168例患者发生黏膜炎,19例患者发生OCLABSI,10例患者发生MCLABSI(其中6例发生下消化道黏膜炎,2例发生口腔黏膜炎)。预处理至发生黏膜炎的时间为9(2~58)d;移植至OCLABSI发生的时间为9(1~31)d;移植至MCLABSI发生的时间为9.5(1~12)d。218例患者的其他基本情况见表 1。
| 表 1 218例HSCT患者的基本信息 Table 1 Basic information of 218 patients with HSCT |
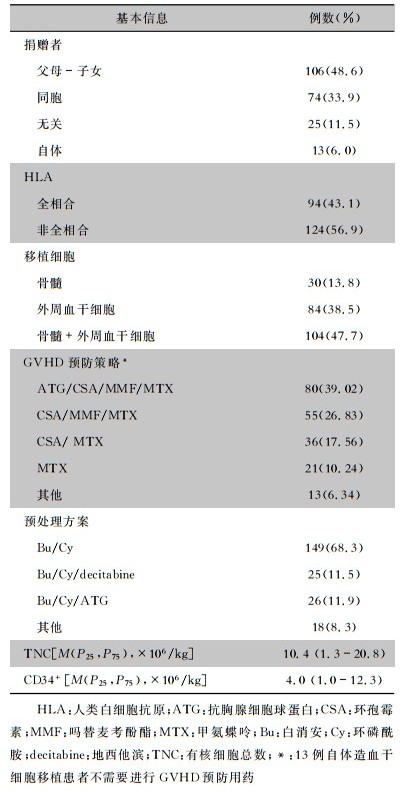
|
19例OCLABSI患者中共检出21株病原菌,其中革兰阳性(G+)菌9株,革兰阴性(G-)菌11株,真菌1株。G+菌中,人葡萄球菌4株,表皮葡萄球菌2株,棒状杆菌2株,溶血葡萄球菌1株。G-菌中,大肠埃希菌7株,肺炎克雷伯菌2株,少动鞘氨醇单胞菌1株,嗜麦芽窄食单胞菌1株。1株真菌为热带假丝酵母菌。9株多重耐药菌株分别为人葡萄球菌(3株)、表皮葡萄球菌(2株)、大肠埃希菌(2株,其中1株为耐碳青霉烯类大肠埃希菌)、棒状杆菌(1株)、溶血葡萄球菌(1株)。随访时2例有混合菌感染的患者因多器官功能衰竭死亡,其余患者均好转。
2.3 HSCT患者OCLABSI的危险因素分析多因素Cox回归分析结果显示,女性患者发生OCLABSI的风险为男性患者的0.088倍(P=0.003)。年龄每增加10岁,发生血流感染的风险增加1.560倍(P=0.034)。与同时移植骨髓干细胞和外周血干细胞的方法相比,只移植骨髓干细胞的患者发生OCLABSI的风险是其4.408倍(P=0.043)。此外,使用ATG/CSA/MMF/MTX预防GVHD的患者,其发生OCLABSI的风险是使用其他非常规的GVHD方案的患者的0.101倍(P=0.019);单独使用MTX预防GVHD的患者,其发生OCLABSI的风险是使用其他非常规GVHD方案患者的0.097倍(P=0.032)。见表 2。
| 表 2 HSCT患者OCLABSI危险因素的Cox回归分析 Table 2 Cox regression analysis on risk factors for OCLABSI in HSCT patients |
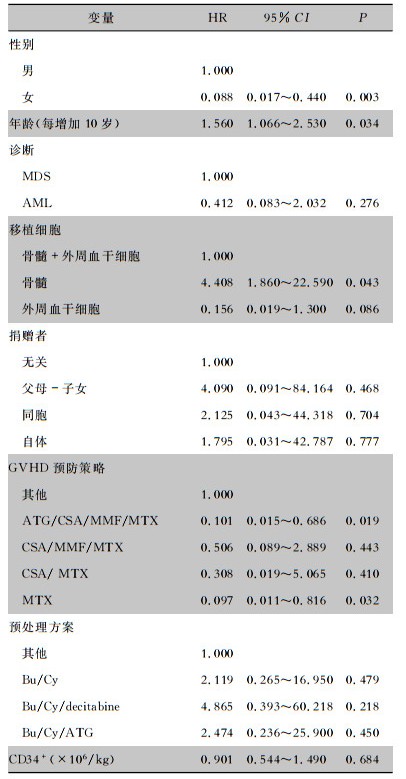
|
全相合和单倍体相合的造血干细胞移植仍然是中、高危AML及高危MDS的首选治疗和强化手段,可提高疾病治愈的概率[7]。患者行HSCT后,发生治疗相关疾病和死亡的风险增加,其中影响患者结局的一大重要事件就是感染[8]。研究[9]表明,HSCT后6个月内发生CLABSI患者的死亡风险是未发生CLABSI患者的近5倍(HR=4.932;95%CI:2.463-9.878;P < 0.001)。此外,CLABSI的发生会延长患者的住院时间,增加经济负担。美国的一项调查结果显示,每例CLABSI的发生会增加11 971~54 000美元的额外治疗费用[10]。作为移植后患者常见的感染类型,可以通过采取预防措施从而避免CLABSI的发生。
引起CLABSI的病原菌大多来自皮肤、口腔和胃肠道[1, 7, 11],MCLABSI患者的导管血或静脉血中培养出的细菌更能准确反映从静脉导管获得的血流感染的致病菌类型,如皮肤表面的条件致病菌。建立专业队伍,加强对PICC操作人员的培训,提高技术熟练度,做好手卫生及消毒灭菌工作,可以有效减少CLABSI的发生。Barrell等[12]的研究表明,通过加强医务人员规范换药及采血操作,使得儿童HSCT患者CLASBI由10.03‰降至3.0‰。移植患者进行大剂量的化学治疗后,消化道黏膜炎的发病风险极高,口咽部和胃肠道的正常菌群通过破损的黏膜进入血流,引起菌血症[13]。然而,这些类型的血流感染也被纳入CLASBI之中。因此,为了提高CLABSI预防措施的精确性,我们认为应该将黏膜屏障破坏导致的继发性血流感染从传统的CLABSI定义中剔除开来。本研究数据显示,发生MCLABSI的患者少于OCLABSI的患者。HSCT患者是CLABSI的高发人群,多因素Cox回归分析发现,年龄、性别、移植细胞类型、GVHD的预防策略均是CLABSI的影响因素。与男性相比,女性HSCT患者发生OCLABSI的风险明显较小,且随着年龄的增加发生OCLABSI的风险增加。除了年龄与性别,GVHD的预防用药也会影响OCLABSI的发生,ATG/CSA/MMF/MTX联合预防及MTX单独预防均可降低OCLABSI的发生风险。而Poutsiaka等[14]的研究则显示,HSCT患者血流感染的发生与之后GVHD的发生存在相关性。移植骨髓和骨髓与外周血干细胞同时移植的患者相比,发生OCLABSI的风险增加。
随着移植、GVHD及免疫抑制时间的延长,HSCT患者发生细菌、真菌及病毒感染的风险增高。感染并发症与患者病死率相关,尤其是在移植后早期阶段[15]。本研究中OCLABSI患者血培养检出的G+菌与G-菌株数相当,G+菌多为皮肤表面定植菌,而G-菌多为肠道正常菌群。耐药细菌的出现,使得这一阶段患者的病情更加复杂。移植早期多重耐药菌感染患者的高病死率,越来越引起医务人员的重视。抗菌药物的经验性使用对于HSCT患者十分重要,但要基于流行病学研究[16]。
本研究存在一定的局限性。首先,本研究是单中心的回顾性研究,仅回顾了该中心2016年11月—2017年11月的HSCT的相关数据,样本量小;其次,本研究仅探讨了AML和MDS两种血液疾病发生OCLABSI的影响因素;此外,未能将血液疾病的严重程度及疾病评分纳入研究。
总之,本研究结果表明HSCT患者发生OCLABSI的病原菌主要为G-菌,OCLABSI的影响因素包括性别(女性的发病风险仅为男性的0.088倍)、年龄(年龄每增加10岁,发生OCLABSI的风险增加1.560倍)、GVHD预防方案。对MCALBSI的定义可以更加精确监测静脉导管引起的血流感染。根据高危因素早期发现高风险人群,严格执行血流感染的预防控制措施,实施增强移植后患者免疫重组的方案,可以减少HSCT患者CLABSI的发生。
| [1] |
Chang AK, Foca MD, Jin Z, et al. Bacterial bloodstream infections in pediatric allogeneic hematopoietic stem cell recipients before and after implementation of a central line-associated bloodstream infection protocol:A single-center experience[J]. Am J Infect Control, 2016, 44(12): 1650-1655. DOI:10.1016/j.ajic.2016.04.229 |
| [2] |
Mackall C, Fry T, Gress R, et al. Background to hematopoietic cell transplantation, including post transplant immune recovery[J]. Bone marrow transplant, 2009, 44(8): 457-462. DOI:10.1038/bmt.2009.255 |
| [3] |
Raad I, Costerton W, Sabharwal U, et al. Ultrastructural analysis of indwelling vascular catheters:a quantitative relationship between luminal colonization and duration of placement[J]. J Infect Dis, 1993, 168(2): 400-407. |
| [4] |
Digiorgio MJ, Fatica C, Oden M, et al. Development of a modi-fied surveillance definition of central line-associated bloodstream infections for patients with hematologic malignancies[J]. Infect Control Hosp Epidemiol, 2012, 33(9): 865-868. DOI:10.1086/667380 |
| [5] |
Centers for Disease Control and Prevention (CDC). Bloodstream infection event (central line-associated bloodstream infection and non-central line associated bloodstream infection)[EB/OL].(2017-12)[2018-1]. https://www.cdc.gov/nhsn/faqs/faq-bsi.html.
|
| [6] |
Lukenbill J, Rybicki L, Sekeres MA, et al. Defining incidence, risk factors, and impact on survival of central line-associated blood stream infections following hematopoietic cell transplantation in acute myeloid leukemia and myelodysplastic syndrome[J]. Biol Blood Marrow Transplant, 2013, 19(5): 720-724. DOI:10.1016/j.bbmt.2013.01.022 |
| [7] |
Lennard AL, Jackson GH. Stem cell transplantation[J]. BMJ, 2000, 321(7258): 433-437. DOI:10.1136/bmj.321.7258.433 |
| [8] |
Poutsiaka DD, Price LL, Ucuzian A, et al. Blood stream infection after hematopoietic stem cell transplantation is associa-ted with increased mortality[J]. Bone Marrow Transplant, 2007, 40: 63-70. DOI:10.1038/sj.bmt.1705690 |
| [9] |
McDonald MK, Culos KA, Gatwood KS, et al. Defining incidence and risk factors for catheter associated bloodstream infections in an outpatient adult hematopoietic cell transplant program[J]. Biol Blood Marrow Transplant, 2018, 24(10): 2081-2087. DOI:10.1016/j.bbmt.2018.04.031 |
| [10] |
Pronovost P, Needham D, Berenholtz S, et al. An intervention to decrease catheter-related bloodstream infections in the ICU[J]. N Engl J Med, 2006, 355(26): 2725-2732. DOI:10.1056/NEJMoa061115 |
| [11] |
Dandoy CE, Ardura MI, Papanicolaou GA. Bacterial bloodstream infections in the allogeneic hematopoietic cell transplant patient:new considerations for a persistent nemesis[J]. Bone Marrow Transplant, 2017, 52(8): 1091-1106. DOI:10.1038/bmt.2017.14 |
| [12] |
Barrell C, Covington L, Bhatia M, et al. Preventive strategies for central line-associated bloodstream infections in pediatric hematopoietic stem cell transplant recipients[J]. Am J Infect Control, 2012, 40(5): 434-439. DOI:10.1016/j.ajic.2011.06.002 |
| [13] |
Yuen KY, Woo PC, Hui CH, et al. Unique risk factors for bacteraemia in allogeneic bone marrow transplant recipients before and after engraftment[J]. Bone Marrow Transplant, 1998, 21(11): 1137-1143. DOI:10.1038/sj.bmt.1701246 |
| [14] |
Poutsiaka DD, Munson D, Price LL, et al. Blood stream infection (BSI) and acute GVHD after hematopoietic SCT (HSCT) are associated[J]. Bone Marrow Transplant, 2011, 46(2): 300-307. DOI:10.1038/bmt.2010.112 |
| [15] |
Saber W, Opie S, Rizzo JD, et al. Outcomes after matched unrelated donor versus identical sibling hematopoietic cell transplantation in adults with acute myelogenous leukemia[J]. Blood, 2012, 119(17): 3908-3916. DOI:10.1182/blood-2011-09-381699 |
| [16] |
Alp S, Akova M. Antibacterial resistance in patients with hematopoietic stem cell transplantation[J]. Mediterr J Hematol Infect Dis, 2017, 9(1): e2017002. |



