假丝酵母菌血症是医院感染主要的侵袭性真菌病。其病死率高达32%~34%[1]。目前针对免疫缺陷患者进行常规预防与经验性全身抗真菌药物治疗,虽然短暂的降低了侵袭性假丝酵母菌血症的病死率,但也改变了侵袭性假丝酵母菌的流行病学。我国近年来文献报道,非白假丝酵母菌感染所占比例已经超过了白假丝酵母菌感染[2-3],这也是导致突破性假丝酵母菌血症病例增多的主要因素。突破性假丝酵母菌血症是指在任何情况下,经过系统性的抗真菌治疗3 d后出现的假丝酵母菌血症[4]。侵袭性假丝酵母菌血症事件中突破性感染发生比率较高,达18%[4]。常见的突破性假丝酵母菌血症菌种有:近平滑假丝酵母菌(Candida parapsilosis,C. parapsilosi)、光滑假丝酵母菌(Candida glabrata, C. glabrata)、克柔假丝酵母菌(Candida krusei, C. krusei)、热带假丝酵母菌(Candida tropicalis, C.tropicalis)等非白假丝酵母菌[4-5],由希木龙假丝酵母菌(Candida haemulonii, C.haemulonii)引起的突破性假丝酵母菌血症报道甚少。本文介绍了一例罕见的希木龙假丝酵母菌在血液恶性肿瘤化学治疗(化疗)后中性粒细胞缺乏期引发的突破性菌血症。
1 病历资料 1.1 病史患者,女,36岁,6年半前确诊非霍奇金淋巴瘤(滤泡细胞型),经多次化疗后部分缓解(达PR)。5个月前出现腹胀、乏力等症状,正电子发射断层扫描/计算机断层扫描(PET/CT)显示:全身弥漫性淋巴结大伴代谢异常、肝浸润、胰腺浸润、右侧胸膜浸润。给予氟达拉滨+环磷酰胺(FC)方案化疗3周期后,达到PR。半个月前患者出现低热、乏力、干咳等不适,2018年8月20日为求进一步治疗入院。
1.2 诊疗经过8月20日入院后予以对症支持治疗。8月31日患者胸闷、气短、乏力、腹胀等症状加重,无发热,左胸腔积液沉渣包埋:见高度可疑恶性细胞,考虑疾病进展,给予FC方案抗肿瘤治疗3 d。9月3日患者化疗后出现咳嗽,咳大量白色黏痰,严重胃肠不良反应等不适。实验室检查:白细胞计数(WBC)2.54×109/L、血红蛋白(HGB)96.6 g/L、中性粒细胞计数(NEU)0.41×109/L、血小板计数(PLT)112×109/L、降钙素原(PCT)0.419 ng/mL、(1, 3)-β-D-葡聚糖[(1, 3)-β-D-glucosan, BDG,简称G试验]抗原检测51.26 pg/mL、乳酸脱氢酶(LDH) 1 723 U/L、钾2.8 mmol/L、钠126 mmol/L、氯84 mmol/L、钙2.0 mmol/L,考虑患者为中性粒细胞缺乏期,给予头孢哌酮/舒巴坦、氟康唑预防性抗感染治疗,纠正离子紊乱,给予肠外营养等治疗,同时送检深部痰标本培养。
9月5日患者血常规检查:WBC 1.05×109/L、HGB 67.5 g/L、NEU 0.21×109/L、PLT 58×109/L,考虑化疗后骨髓抑制导致,给予粒细胞集落刺激因子、输注红细胞悬液支持治疗。9月6日患者痰细菌培养结果:白假丝酵母菌约占60%,考虑为局部定植菌。9月7日患者胸闷、咳嗽症状加重,体温达38.5℃,无寒战。血常规检查:WBC 0.47×109/L、NEU 0.37×109/L、中性粒细胞百分比(NEU%) 76.50%。因头孢哌酮/舒巴坦抗感染治疗已持续4 d,但患者突发高热,升阶美罗培南继续抗感染治疗,并送血培养(单套瓶:需氧瓶、厌氧瓶)。9月12日患者血常规检查:WBC 1.64×109/L、NEU 1.23×109/L、NEU% 75.10%,血培养初步鉴定为酵母样真菌孢子,考虑患者有突破性菌血症并产生多重耐药菌的可能,患者已行抗真菌治疗10 d,高热症状仍未好转,提示感染未得到控制。调整抗真菌方案:停用氟康唑,更换米卡芬净钠。因患者可自行进食,停止肠外营养。9月14日实验室检查:WBC 2.69×109/L、NEU 2.05×109/L、NEU% 76.20%、LDH 534 U/L,血培养梅里埃VITEK MS全自动快速微生物质谱检测系统鉴定为希木龙假丝酵母菌,药敏试验显示:对氟康唑、伊曲康唑、5-氟胞嘧啶、伏立康唑、两性霉素B均耐药,对米卡芬净、卡泊芬净均敏感。9月14日患者由于经济原因要求停止抗真菌治疗。9月17日患者高热症状未见好转,最高达38.6℃。血常规检查:WBC 4.68×109/L、NEU% 88.84%,送检血培养(单套瓶),给予卡泊芬净治疗。9月19日患者仍发热、咳嗽,体温波动在38.4℃左右,G试验<10 pg/mL。9月22日患者WBC 5.52×109/L、NEU 3.86×109/L、NEU% 69.9%,血培养结果:阴性。患者高热症状未明显缓解。LDH 1 353 U/L,再度出现增高,可能是肿瘤负荷量增高所致。9月3—22日该患者临床病程及抗菌药物治疗经过见图 1。
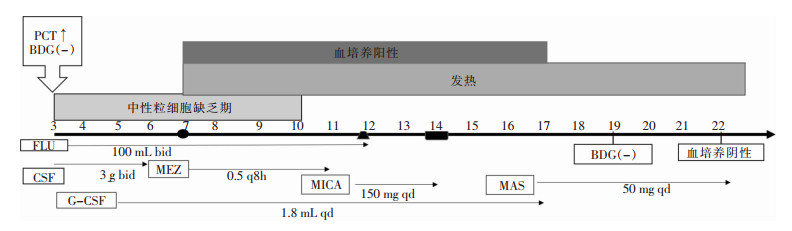 |
| 注:FLU:氟康唑;CSF:头孢哌酮/舒巴坦;MEZ:美罗培南;MICA:米卡芬净;MAS:卡泊芬净;G-CSF:中性粒细胞集落刺激因子;●:发生突破性假丝酵母菌血症时间;▲:血培养一级报告时间;■:血培养结果为希木龙假丝酵母菌报告时间 图 1 9月3—22日患者临床病程及抗菌药物治疗经过 |
9月22日患者及家属要求出院。出院诊断:非霍奇金淋巴瘤(滤泡细胞型进展期IV期A,侵及双锁骨上、纵隔、腹腔、后腹腔淋巴结、腹膜、脾、肺);左侧胸腔积液;心包积液;菌血症。随访得知患者于10月22日死亡。
2 分析与讨论希木龙假丝酵母菌在沙堡弱培养基上呈白色、光滑、类酵母型菌落,见图 2A;于显微镜下呈现卵圆形或球形的出芽酵母样细胞,见图 2B,不产生假菌丝,芽管形成试验阴性,尿素水解试验阴性,环己亚胺培养基生长阳性,可在37℃温度下生长[6];在科玛嘉念珠菌显色平板菌落为光滑粉色小菌落,见图 2C,通过Phoenix—100全自动微生物鉴定系统鉴定为希术龙假丝酵母菌。检验人员使用梅里埃VITEK MS全自动快速微生物质谱检测系统,确定该真菌为希术龙假丝酵母菌, 置信度99.9%。该菌对两性霉素B及三唑类抗真菌药物普遍具有耐药性,对米卡芬净、卡泊芬净敏感[6-8], 与本病例所得结果一致。回顾文献[7-8],希木龙假丝酵母菌感染患者的危险因素包括:有严重基础疾病、中心静脉置管、中性粒细胞减少症、浅表伤口等,其临床表现以发热为主,与其他医院感染相比临床表现无特异性,其传播似乎与环境污染相关[6-7]。近几年陆续报道的“超级真菌”耳假丝酵母菌(Candida auris,C.auris),与希木龙假丝酵母菌是酵母属进化分支中具有多重耐药性倾向的系统发育相关物种,传统酵母生化鉴定仪无法将两者区分。Khan等[9]研究发现经过VITEK 2鉴别166株为希木龙假丝酵母菌,再通过DNA序列分析其中有158株为耳假丝酵母菌。2018年中国也有类似报道[10]。两种罕见的真菌虽然均为多重耐药菌种,但耳假丝酵母菌具有高侵袭性和高病死率等特点[11]。一些动物实验也对此进行了验证,耳假丝酵母菌感染的小鼠模型表现的侵袭性、毒性、致死性略低于白假丝酵母菌,远高于希木龙假丝酵母菌[12]。虽然希木龙假丝酵母菌血症致死罕见,但在新生儿、导管相关感染及中性粒细胞减少症中也有报道[7, 13-14], 由此可见菌种的准确鉴定至关重。目前区分耳假丝酵母菌与希木龙假丝酵母菌最准确的鉴定方法是DNA测序或基质辅助激光解吸电离飞行时间质谱技术(matrix-assisted laser desorption ionization time -of-flight mass spectrometry, MALDI-TOF MS)[6-8, 15]。
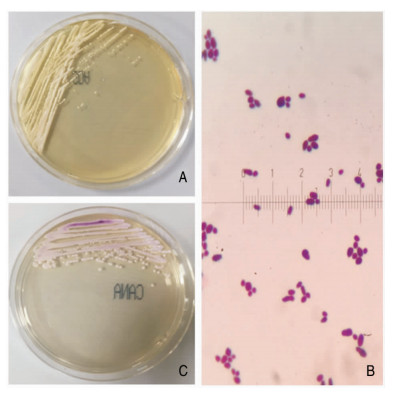 |
| A:在沙堡弱培养基上;B:革兰染色;C:在科玛嘉念珠菌显色平板上 图 2 希木龙假丝酵母菌在培养基上生长形态及革兰染色结果 |
突破性假丝酵母菌血症危险因素包括恶性血液肿瘤、胃肠黏膜炎、移植物抗宿主病、长期或者严重的中性粒细胞减少,接受预防性或经验性抗真菌药物(尤其氟康唑暴露史)治疗,使用糖皮质激素、免疫抑制剂等药物、肠外营养等[1, 4, 5]。一项七年的回顾性研究[16]发现血液系统恶性肿瘤突破性假丝酵母菌血症的比率高达72%。本例患者为恶性血液肿瘤(非霍奇金淋巴瘤)伴中性粒细胞缺乏,同时使用免疫抑制剂(氟达拉滨、环磷酰胺化疗)、肠外营养、氟康唑预防性抗真菌治疗,5个突破性假丝酵母菌血症的危险因素。
根据《血液病/恶性肿瘤侵袭性念珠菌病诊断标准和治疗原则(第五次修订版)》[17],侵袭性真菌血症完全缓解的标准为:患者在观察期内存活,且菌血症相关症状和体征、影像学异常全部消失,血液真菌培养及G实验连续2次或以上阴性提示真菌清除。此外美国临床实验室标准化协会(CLSI)在血培养指南中,推荐采集不同部位2~3套血培养瓶, 成人每套血培养瓶推荐20 mL,有助于区分污染菌和提高阳性检出率。血培养仍然是诊断侵袭性真菌血症的金标准,但其敏感性仅约50%[18]。目前广泛应用于临床真菌抗原检测G试验可用于除接合菌及隐球菌外真菌感染的早期诊断。文献报道G试验在突破性真菌血症的患者检测值明显低于正常值[19]。在血液恶性肿瘤患者中G试验连续2次检测特异性、敏感性、阴性预测值、阳性预测值分别是98.9%、49.6%、94.6%、83.5%[20],说明在该类患者中尽管阴性预测值较高,但由于敏感性较低,BDG值阴性应谨慎解释,且应结合临床、影像学、微生物学结果。综上所述,分析本例患者最后一次血培养过程:培养瓶为单套(需氧瓶、厌氧瓶)、仅1次血培养、长期应用抗真菌药物期间采血,同时也未进行连续2次以上G试验检测,极易造成假阴性。由此无法定义此患者真菌是否清除,同时患者高热症状未缓解,也无法定义发热是真菌血症未治愈还是非霍奇金淋巴瘤进展期并发症。
总之, 希望本病例可以给临床医生和检验人员警示。临床医生对于高危人群,尤其是恶性血液肿瘤患者伴中性粒细胞减少患者,长期给予低剂量三唑类抗真菌药物进行预防性治疗时,应高度警惕突破性假丝酵母菌血症的发生,同时也应加强对侵袭性真菌血流感染早期诊断及血培养送检指征的认知。对于检验工作人员应高度重视真菌检测能力,以免误诊、漏诊。
| [1] |
Orasch C, Mertz D, Garbino J, et al. Fluconazole non-susceptible breakthrough candidemia after prolonged low-dose prophy- laxis: a prospective FUNGINOS study[J]. Infect, 2018, 76(5): 489-495. |
| [2] |
Sun M, Chen C, Xiao W, et al. Increase in Candida parapsilosis candidemia in cancer patients[J]. Mediterr J Hematol Infect Dis, 2019, 11(1): e2019012. |
| [3] |
Lin S, Chen R, Zhu S, et al. Candidemia in adults at a tertiary hospital in China: clinical characteristics, species distribution, resistance, and outcomes[J]. Mycopathologia, 2018, 183(4): 679-689. DOI:10.1007/s11046-018-0258-5 |
| [4] |
Breda GL, Tuon FF, Meis JF, et al. Breakthrough candidemia after the introduction of broad spectrum antifungal agents: a 5-year retrospective study[J]. Med Mycol, 2018, 56(4): 406-415. DOI:10.1093/mmy/myx077 |
| [5] |
Kontoyiannis DP, Reddy BT, Hanna H, et al. Breakthrough candidemia in patients with cancer differs from de novo candidemia in host factors and Candida species but not intensity[J]. Infect Control Hosp Epidemiol, 2002, 23(9): 542-545. DOI:10.1086/502104 |
| [6] |
Muro MD, Motta Fde A, Burger M, et al. Echinocandin resistance in two Candida haemulonii isolates from pediatric patients[J]. Clin Microbiol, 2012, 50(11): 3783-3785. DOI:10.1128/JCM.01136-12 |
| [7] |
Kim MN, Shin JH, Sung H, et al. Candida haemulonii and closely related species at 5 university hospitals in Korea: identification, antifungal susceptibility, and clinical features[J]. Clin Infect Dis, 2009, 48(6): e57-e61. DOI:10.1086/597108 |
| [8] |
Ben-Ami R, Berman J, Novikov A, et al. Multidrug-resistant Candida haemulonii and C. auris, Tel Aviv, Israel[J]. Emerg Infect Dis, 2017, 23(1). DOI:10.3201/eid2302.161486 |
| [9] |
Khan Z, Ahmad S, Al-Sweih N, et al. Increasing prevalence, molecular characterization and antifungal drug susceptibility of serial Candida auris isolates in Kuwait[J]. PLoS One, 2018, 13(4): e0195743. DOI:10.1371/journal.pone.0195743 |
| [10] |
Tian S, Rong C, Nian H, et al. First cases and risk factors of super yeast Candida auris infection or colonization from Shenyang, China[J]. Emerg Microbes Infect, 2018, 7(1): 128. |
| [11] |
Chowdhary A, Sharma C, Meis JF. Candida auris: a rapidly emerging cause of hospital-acquired multidrug-resistant fungal infections globally[J]. PLoS Pathog, 2017, 13(5): e1006290. DOI:10.1371/journal.ppat.1006290 |
| [12] |
Fakhim H, Vaezi A, Dannaoui E, et al. Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine models[J]. Mycoses, 2018, 61(6): 377-382. DOI:10.1111/myc.12754 |
| [13] |
Almeida JN Jr, Motta AL, Rossi F, et al. First report of a clinical isolate of Candida haemulonii in Brazil[J]. Clinics (Sao Paulo), 2012, 67(10): 1229-1231. DOI:10.6061/clinics/2012(10)18 |
| [14] |
Khan ZU, Al-Sweih NA, Ahmad S, et al. Outbreak of fungemia among neonates caused by Candida haemulonii resistant to amphotericin B, itraconazole, and fluconazole[J]. J Clin Microbiol, 2007, 45(6): 2025-2027. DOI:10.1128/JCM.00222-07 |
| [15] |
Galán F, García-Agudo L, Guerrero I, et al. Evaluation of mass spectrometry for the identification of clinically interesting yeasts[J]. Enferm Infecc Microbiol Clin, 2015, 33(6): 372-378. DOI:10.1016/j.eimc.2014.10.003 |
| [16] |
Sipsas NV, Lewis RE, Tarrand J, et al. Candidemia in patients with hematologic malignancies in the era of new antifungal agents (2001-2007): stable incidence but changing epidemiology of a still frequently lethal infection[J]. Cancer, 2009, 115(20): 4745-4752. DOI:10.1002/cncr.24507 |
| [17] |
中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第五次修订版)[J]. 中华内科杂志, 2017, 56(6): 453-459. DOI:10.3760/cma.j.issn.0578-1426.2017.06.015 |
| [18] |
Clancy CJ, Nguyen MH. Finding the "missing 50%" of invasive candidiasis: how nonculture diagnostics will improve understanding of disease spectrum and transform patient care[J]. Clin Infect Dis, 2013, 56(9): 1284-1292. DOI:10.1093/cid/cit006 |
| [19] |
Abe M, Kimura M, Araoka H, et al. Serum (1, 3)-beta-D-glucan is an inefficient marker of breakthrough candidemia[J]. Med Mycol, 2014, 52(8): 835-840. DOI:10.1093/mmy/myu066 |
| [20] |
Lamoth F, Cruciani M, Mengoli C, et al. β-Glucan antigenemia assay for the diagnosis of invasive fungal infections in patients with hematological malignancies: a systematic review and meta-analysis of cohort studies from the Third European Conference on Infections in Leukemia (ECIL-3)[J]. Clin Infect Dis, 2012, 54(5): 633-643. DOI:10.1093/cid/cir897 |



