2. 华中科技大学同济医学院附属同济医院胸外科, 湖北 武汉 430030
2. Department of Thoracic Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
肺癌的发病率和死亡率位列我国恶性肿瘤之首,其中以老年患者更为多见。随着我国社会老龄化进展,老龄肺癌的诊治成为临床医生需要面对的越来越严峻的问题。对于可切除的肺部肿瘤,外科手术仍然是肺癌综合治疗的重要手段,从传统开胸手术到电视辅助胸腔镜手术,手术方式和手术范围向着微创化方向发展,治疗效果也得到显著改善,患者5年生存率大大提高[1]。但因肺癌手术创伤大,对呼吸循环影响明显,围手术期风险增高,如何减少术后并发症尤其是术后肺炎的发生,是医务人员面临的一道难题。术后肺炎(postoperative pneumonia)是肺癌手术常见的并发症之一,研究报道肺癌手术术后肺炎发生率差异较大,为1.32%~25%[2-4]。目前,对于70岁以上的老年非小细胞肺癌患者术后肺炎发生情况,国内外报道较少[5-6]。老年肺癌患者由于呼吸道纤毛动力下降,胸廓弹性下降,清除呼吸道病原体能力下降,并且常合并有糖尿病、冠心病、慢性阻塞性肺疾病(COPD)等基础疾病,术后易发生术后肺炎。为更好的研究老年肺癌患者术后肺炎的危险因素,并提出预防对策,本研究回顾性分析本院2016年1月—2018年11月进行手术治疗的398例70岁以上老年肺癌患者病例资料,以及术后肺炎发生情况,并对相关影响因素进行分析评估,结果报告如下。
1 资料与方法 1.1 资料来源收集武汉同济医院胸外科2016年1月—2018年11月收治的接受手术治疗且年龄≥70岁的肺癌患者作为研究对象。所有患者均经病理诊断为非小细胞肺癌。入选标准:(1)均行肺癌切除术;(2)术前均戒烟两周以上,并行指导下呼吸训练,直至熟练掌握;(3)术后鼓励患者咳嗽3次/d以上,术后2 d内即可下床活动;(4)年龄≥70岁;(5)术前未发生急性感染者;(6)自愿参加,并遵循保密原则。排除标准:(1)对肺癌手术不耐受者;(2)合并严重的心肺功能、肝肾功能损伤者;(3)有广泛转移的晚期肺癌患者。本研究经患者及家属知情同意,并获得医院伦理委员会审批。
1.2 术后肺炎诊断标准术后肺炎定义为外科手术患者在术后30 d内新发的肺炎,其诊断标准参照我国卫生行业标准《肺炎诊断》(WS 382-2012)[7],需同时满足以下三条:(1)至少行两次胸片检查(对无心、肺基础疾病,如呼吸窘迫综合征、支气管肺发育不良、肺水肿、慢性阻塞性肺疾病或充血性心力衰竭等的患者,可行一次胸片检查),并至少符合以下一项:①新出现或进行性发展且持续存在的肺部浸润阴影;②实变;③空洞形成。(2)至少符合以下一项:①发热(体温>38℃)且无其他明确原因;②外周血WBC>12×109/L或<4×109/L;③年龄≥70岁的老年人没有其他明确原因而出现神志改变;(3)至少符合以下两项:①新出现的脓痰或痰的性状发生变化,或呼吸道分泌物增多,或需要吸痰次数增多;②新出现的咳嗽、呼吸困难或呼吸频率加快,或原有的咳嗽、呼吸困难或呼吸急促加重;③肺部啰音或支气管呼吸音;④气体交换情况恶化,氧需求量增加或需要机械通气支持。
1.3 研究方法采用回顾性研究方法,收集患者的临床资料,包括性别、年龄[8-10]、基础疾病(高血压、冠心病、糖尿病、COPD等)、FEV1%、手术方式、手术范围、手术时长、术后住院时间、联用抗菌药物及联用抗菌药物日数、围手术期血清清蛋白、血红蛋白、术前是否行新辅助放射治疗、化学治疗以及二次手术等。2016—2018年胸外科手卫生依从率在75%左右,医院感染率在1.90%左右,故未将手卫生等指标纳入医院感染相关因素分析。对术后发生肺炎的患者,记录其送检痰标本、纤支镜冲洗液标本检出病原菌。分离菌株经法国梅里埃VITEK-32全自动分析仪鉴定,使用K-B纸片法进行药敏试验。
1.4 变量的设置与赋值根据单因素分析结果,将75岁以上作为术后肺炎危险因素。同时,选择FEV1%<70、开胸手术、肺叶切除、手术时长≥180 min、血清清蛋白<35 g/L、血红蛋白<70 g/L作为危险因素指标。
1.5 统计分析应用SPSS 21.0软件进行数据统计,计数资料采用χ2检验;将单因素分析有统计学意义的危险因素纳入多因素分析,多因素分析采用logistic回归分析,P≤0.05表示差异有统计学意义。
2 结果 2.1 患者基本情况共收集398例老年非小细胞肺癌行手术患者,其中胸腔镜手术272例(68.34%),开胸手术126例(31.66%);肺叶切除术291例(73.12%),肺段切除术95例(23.87%),全肺切除术12例(占3.01%)。发生术后肺炎36例,感染率为9.05%。
2.2 检出病原菌36例诊断为术后肺炎的患者呼吸道标本检出病原菌43株,其中革兰阴性菌20株(占46.51%),革兰阳性菌9株(占20.93%),真菌14株(占32.56%)。革兰阴性菌排名前三位的为铜绿假单胞菌(6株,30.00%)、鲍曼不动杆菌(6株,30.00%)和肺炎克雷伯菌(5株,25.00%);革兰阳性菌主要为金黄色葡萄球菌(8株,88.89%);真菌主要为白假丝酵母菌(12株,85.71%)。
2.3 术后肺炎单因素分析分析老年非小细胞肺癌患者术后肺炎相关的临床特征,结果显示,年龄≥75岁、合并COPD、FEV1% < 70、开胸手术、肺叶切除、手术时长≥180 min、血清清蛋白<35 g/L与术后肺炎的发生相关,差异均有统计学意义(均P<0.05),见表 1。
| 表 1 老年非小细胞肺癌患者术后肺炎单因素分析 Table 1 Univariate analysis on postoperative pneumonia in elderly patients with NSCLC |
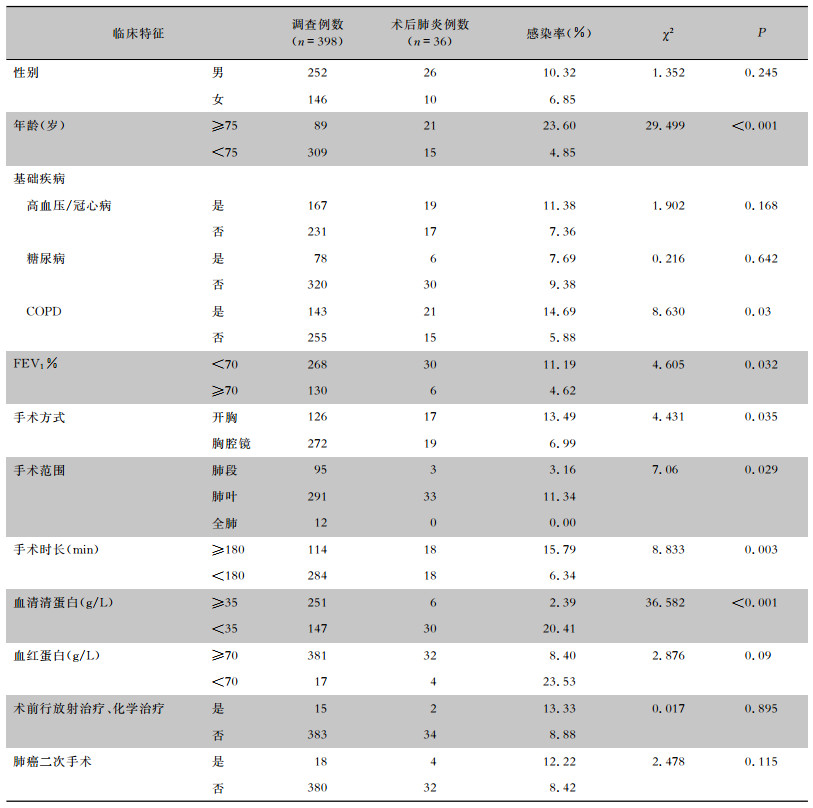
|
多因素logistic回归分析结果显示,年龄≥75岁、合并COPD、FEV1%<70、开胸手术、肺叶切除、手术时长≥180 min、血清清蛋白<35 g/L是导致术后肺炎的独立影响因素(均P<0.05),见表 2。
| 表 2 老年非小细胞肺癌患者术后肺炎多因素logistic回归分析 Table 2 Multivariate logistic regression analysis on postope -rative pneumonia in elderly patients with NSCLC |
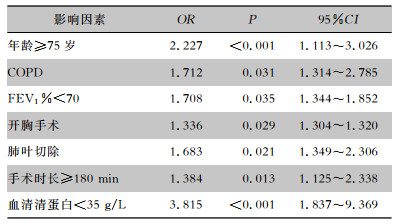
|
术后肺炎为肺癌手术常见的术后并发症和医院感染类型,其延长患者的住院时间,影响患者预后,增加患者的住院费用及死亡风险。目前,国内外尚缺少术后肺炎相应的定义、诊断标准和防控指南。由于缺少术后肺炎统一的定义,国内外文献对肺癌术后肺炎报道[2-4]差异较大,发生率为1.32%~25%。华西医院宗志勇等[11]综合国内外相关文献,结合我国实际情况并兼顾可操作性,提出了术后肺炎的定义,并参考美国等其他国家的诊断标准,将我国卫生部2012年颁发的《肺炎诊断》作为术后肺炎的诊断标准,此标准目前在临床上得到广泛应用。Simonsen等[12]在肺癌手术后长期随访中发现,术后发生肺炎的患者在术后31~365 d病死率达21.6%,而术后未发生肺炎患者病死率仅为16.8%。术后肺炎不仅病死率高,而且显著增加患者的住院费用,导致住院时间延长,给家庭、社会造成了沉重的心理负担和经济负担。国内研究[10]显示,胸外科手术后发生术后肺炎患者的平均住院时间为21 d。与此同时,韩叙等[13]基于疾病诊断相关分组(DRGs)的老年患者医院感染疾病负担评价发现,呼吸系统疾病中发生医院感染组病例平均住院日最长,为21.9 d;医院感染组费用为8.2万元/例,而未发生医院感染组为2.78万元/例。老年患者多合并糖尿病、冠心病、COPD等慢性基础疾病,免疫力低下,机体功能也相应减退,容易发生术后肺炎等并发症。本研究所选取的398例70岁以上的老年非小细胞肺癌患者,术后肺炎发病率高达9.05%,警示应对老年非小细胞肺癌患者围手术期进行严密观察,并做好预防控制措施,减少术后肺炎的发生。
36例老年非小细胞肺癌术后肺炎患者呼吸道标本检出病原菌共43株,其中革兰阴性菌20株,革兰阳性菌共9株,真菌14株。术后肺炎病原菌以COPD等基础疾病常见病原菌为主,推测与术前病原菌呼吸道定植有关[14-15]。
研究[16-17]表明,老年患者机体功能下降、高龄、合并COPD、吸烟史是发生术后肺炎的危险因素。由于吸烟是早已证实的独立危险因素,故本研究纳入了高龄、COPD等基础疾病做单因素分析。亦有研究指出,肺功能临界状态或低肺功能也是术后肺炎的危险因素[14]。FEV1%反映气道受阻程度,常用于判定手术的安全性及发生感染的危险程度,故本研究选取FEV1%纳入单因素分析。研究[18-19]表明,胸腔镜手术、单纯肺段切除较开胸手术、肺叶切除的术后肺炎感染风险小,患者有二次手术史、术前行放射治疗、化学治疗,也会增加术后肺炎发生的风险[20],以上因素均纳入本研究的单因素分析。本研究中老年患者术后肺炎发病率男性高于女性,合并有高血压/冠心病感染率高于非基础疾病组,血红蛋白<70 g/L患者感染率较≥70 g/L患者感染率高,开胸手术比胸腔镜手术感染率高、肺叶切除比肺段切除感染率高。同时术前行放射治疗、化学治疗或肺癌二次手术术后感染率数值上较高,但差异无统计学意义。
多因素logistic回归分析显示,年龄≥75岁、合并COPD、FEV1%<70、开胸手术、肺叶切除、手术时长≥180 min、血清清蛋白<35 g/L是老年非小细胞肺癌患者术后肺炎的独立危险因素。高龄患者身体机能较差,免疫力低下,与术后免疫状态相关,血清清蛋白低下预示着患者的营养状态不佳,一定程度上增加了术后肺炎的风险。合并COPD可影响心肺功能导致呼吸功能恶化,增加术后肺炎的风险。FEV1%<70说明患者呼气功能较差,如果有痰液,咳出较困难。本研究显示缩短手术时长,减少组织暴露时间,减少病原菌接触机会,亦可以减少术后肺炎等并发症。
综上所述,老年非小细胞肺癌患者术后肺炎的发生受到多种因素影响,应针对危险因素做好相应的预防控制措施。积极治疗基础疾病,纠正、控制血糖、高血压;术前对高龄合并COPD患者进行呼吸训练,并对这些方法的重要性进行宣教;加强营养,矫正血清清蛋白到正常范围。同时,对高龄患者应尽量采取创伤较少的方式,如胸腔镜微创切除等。术中应缩短手术时长,术后积极送检痰标本行病原菌培养及药敏试验。预防老年非小细胞肺癌患者术后肺炎的发生,涉及术前、术中、术后多种危险因素的干预与管理,需要胸外科、麻醉科、康复科、医院感染管理科等多学科合作,通过全程、全员防控措施的实施,为患者带来更大益处。
本研究存在一定的局限性。首先,本研究是单中心回顾性研究,选取的标本量较少,代表性有待于进一步验证;其次,在术后危险因素研究中,对于呼吸道分泌物清除、药物使用及理疗情况未能记录比较;未能将术后肺炎发生的严重程度及评分纳入研究。因此,仍需进一步研究以完善本研究结论。
| [1] |
张敏璐, 吴春晓, 龚杨明, 等. 上海人群肺癌生存率分析[J]. 中国癌症杂志, 2017, 27(5): 326-333. |
| [2] |
Schussler O, Alifano M, Dermine H, et al. Postoperative pneumonia after major lung resection[J]. Am J Respir Crit Care Med, 2006, 73(10): 1161-1169. |
| [3] |
Lee JY, Jin SM, Lee CH, et al. Risk factors of postoperative nosocomial pneumonia after lung cancer surgery[J]. J Korean Med Sci, 2011, 26(8): 979-984. DOI:10.3346/jkms.2011.26.8.979 |
| [4] |
Sandri A, Papagiannopoulos K, Milton R, et al. Major morbidity after video-assisted thoracic surgery lung resections: a comparison between the European Society of Thoracic Surgeons definition and the thoracic morbidity and mortality system[J]. J Thorac Dis, 2015, 7(7): 1174-1180. |
| [5] |
诸静兰, 陈惠, 栾伟. 老年肺癌患者术后合并下呼吸道感染的相关因素分析[J]. 国际肿瘤学杂志, 2016, 43(2): 95-98. DOI:10.3760/cma.j.issn.1673-422X.2016.02.004 |
| [6] |
魏娟娟. 老年肺癌放化疗前后肺部感染的病原菌培养及药敏分析[J]. 实用癌症杂志, 2017, 32(3): 466-468. DOI:10.3969/j.issn.1001-5930.2017.03.035 |
| [7] |
中华人民共和国卫生部. 肺炎诊断(WS 382-2012)[J]. 北京:中国标准出版社, 2012. |
| [8] |
赵守华, 刘向阳, 张德超, 等. 70岁以上老年肺癌患者术后严重并发症和死亡危险因素分析[J]. 中华老年医学杂志, 2006, 25(9): 660-663. DOI:10.3760/j:issn:0254-9026.2006.09.004 |
| [9] |
Chughtai M, Gwam CU, Mohamed N, et al. The epidemiology and risk factors for postoperative pneumonia[J]. J Clin Med Res, 2017, 9(6): 466-475. |
| [10] |
许缤, 陈红岩, 孙嫣, 等. 胸外科手术后医院获得性肺炎危险因素分析[J]. 中华医院感染学杂志, 2012, 22(1): 64-66. |
| [11] |
中华预防医学会医院感染控制分会第四届委员会重点部位感染防控学组. 术后肺炎预防和控制专家共识[J]. 中华临床感染病杂志, 2018, 11(1): 11-19. DOI:10.3760/cma.j.issn.1674-2397.2018.01.003 |
| [12] |
Simonsen DF, Søgaard M, Bozi I, et al. Risk factors for postoperative pneumonia after lung cancer surgery and impact of pneumonia on survival[J]. Respir Med, 2015, 109(10): 1340-1346. DOI:10.1016/j.rmed.2015.07.008 |
| [13] |
韩叙, 王力红, 李小莹, 等. 基于DRGs的老年患者医院感染疾病负担评价[J]. 中国医院管理, 2018, 38(10): 51-53. |
| [14] |
高珂, 赖玉田, 黄健, 等. 肺癌肺叶切除患者术前存在气道定植菌与术后肺炎的发生有相关性吗?[J]. 中国肺癌杂志, 2017, 20(4): 239-247. |
| [15] |
Rolston KV. Infections in cancer patients with solid tumors: a review[J]. Infect Dis Ther, 2017, 6(1): 69-83. DOI:10.1007/s40121-017-0146-1 |
| [16] |
杨利红, 徐旋里, 周建英. 老年肺癌手术并发症及相关因素[J]. 中国老年学, 2015, 35(12): 3320-3322. DOI:10.3969/j.issn.1005-9202.2015.12.061 |
| [17] |
Hashimoto N, Matsuzaki A, Okada Y, et al. Clinical impact of prevalence and severity of COPD on the decision-making process for therapeutic management of lung cancer patients[J]. BMC Pulm Med, 2014, 14: 14. DOI:10.1186/1471-2466-14-14 |
| [18] |
李纪远, 张灿斌, 马新, 等. 胸腔镜肺叶切除术治疗非小细胞肺癌效果及生存分析[J]. 中国老年学杂志, 2019, 39(12): 2882-2884. DOI:10.3969/j.issn.1005-9202.2019.12.017 |
| [19] |
Yang R, Wu Y, Yao L, et al. Risk factors of postoperative pulmonary complications after minimally invasive anatomic resection for lung cancer[J]. Ther Clinic Risk Manag, 2019, 15: 223-231. DOI:10.2147/TCRM.S195010 |
| [20] |
车国卫, 吴齐飞, 邱源, 等. 多学科围手术期气道管理中国专家共识(2018版)[J]. 中国胸心血管外科临床杂志, 2018, 25(7): 545-549. |



