铜绿假单胞菌(Pseudomonas aeruginosa,PA)是医院感染常见非发酵革兰阴性机会致病菌。PA与宿主作用复杂,能产生外毒素、弹性蛋白酶、鼠李糖脂、绿脓素及外源凝集素等多种毒力因子,并对多种抗菌药物天然或获得性耐药,被认为是最危险的病原菌之一[1-2]。目前,临床上抗菌药物不合理使用情况较为常见,导致PA对各种抗菌药物的耐药性演变更快[3-4],使得多重耐药PA(multidrug-resistance,MDR-PA)、泛耐药PA(extensive drug-resistance,XDR-PA)、耐碳青霉烯类PA(carbapenem-resistance,CRPA)的检出率逐年增高。此类菌株所致感染病情重,病死率高,是当前困扰抗感染治疗的严重问题[5-6]。本研究回顾性分析上海某三甲医院PA菌株的临床分布,并确定其多重耐药菌株流行情况,为PA感染的经验性治疗, 抗菌药物合理选择及感染控制提供依据。
1 材料与方法 1.1 菌株来源收集2014年1月—2017年12月上海某三甲医院送检的各类感染标本中分离的非重复PA。该院现核定床位数1 800余张,年度收治门急诊患者400万余人次,出院人数12万余,住院手术9万余人次。
1.2 试剂及仪器哥伦比亚血琼脂、麦康凯、巧克力和水解酪蛋白平板为上海科玛嘉微生物技术有限公司产品,VITEK 2 Compact全自动微生物分析系统及配套鉴定、药敏卡为法国生物梅里埃公司产品,药敏纸片购自英国Oxoid公司。
1.3 细菌鉴定及药敏试验送检标本分别接种哥伦比亚血琼脂和麦康凯平板,呼吸道标本再增加接种巧克力平板,35℃ 5% CO2环境培养过夜[7]。对培养出的可疑菌落进行PA鉴定。纸片扩散(K-B)法和仪器法对菌株进行药物敏感性检测,依据美国临床实验室标准化协会(CLSI)2017年折点标准判断药敏结果。质控菌株为大肠埃希菌ATCC 35218和铜绿假单胞菌ATCC 27853,由上海市临床检验中心提供。
1.4 MDR-PA、XDR-PA和CRPA的定义定义MDR-PA、XDR-PA的8类抗菌药物为氨基糖苷类、抗假单胞菌碳青霉烯类、抗假单胞菌头孢菌素类、抗假单胞菌氟喹诺酮类、抗假单胞菌β-内酰胺/β-内酰胺酶抑制剂复合物类、单环β-内酰胺类、磷霉素类和脂肽类(粘菌素、多粘菌素B),其中3类或以上(每类中1种或以上)不敏感为MDR-PA,6类或以上(每类中1种或以上)不敏感为XDR-PA[8],对任何碳青霉烯类抗生素(亚胺培南和美罗培南)耐药即定义为CRPA。因本院临床未常规检测PA对磷霉素和脂肽类的敏感性,因此本研究计算MDR-PA和XDR-PA数量时未予考虑。
1.5 统计学分析应用WHONET 5.6软件分析菌株分布和耐药性。应用SPSS 22.0软件对痰与非痰标本药敏结果进行卡方检验,P≤0.05为差异有统计学意义。采用拟合函数曲线判断菌株数量随年份、性别变化趋势。
2 结果 2.1 菌株分离情况2014—2017年全院共分离菌株11 177株,其中PA 1 218株(占10.9%)。采用一元线性回归方程(R2=0.854,P=0.076)分析PA菌株数量变化,总体呈逐年上升趋势。见图 1。
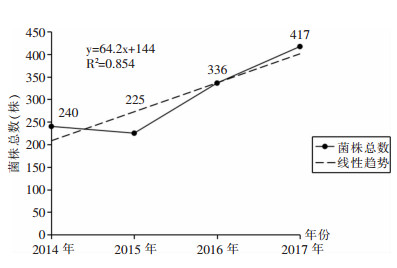 |
| 图 1 2014—2017年分离PA的菌株数及变化趋势 Figure 1 Number and changing trend of PA isolated from 2014 to 2017 |
尿标本分离菌株最多(4 900株,占43.8%),其次为痰(3 199株,占28.6%)。914株PA分离自痰标本,占PA株数的75.0%,占痰中分离菌株数的28.6%;129株PA分离自尿标本,占PA株数的10.6%,占尿中分离菌株数的2.6%;血是PA分离的主要无菌部位标本之一,占2.3%。见表 1。
| 表 1 2014—2017年PA标本来源分布 Table 1 Distribution of PA specimens from 2014 to 2017 |

|
2014—2017年泌尿外科分离病原菌最多(2 351株,占21.0%),其次为老年医学科和门诊,分别为1 470株(13.2%)和1 206株(10.8%),重症监护病房(ICU)位列第四(6.7%)。PA主要分离自老年医学科,占PA菌株的44.9%,占该科室分离菌株数的37.2%;ICU和呼吸科PA各108株,各占PA菌株的8.9%,分别占两科室分离菌株数的14.4%和24.9%。见表 2。
| 表 2 2014—2017年PA科室来源分布 Table 2 Department distribution of PA from 2014 to 2017 |
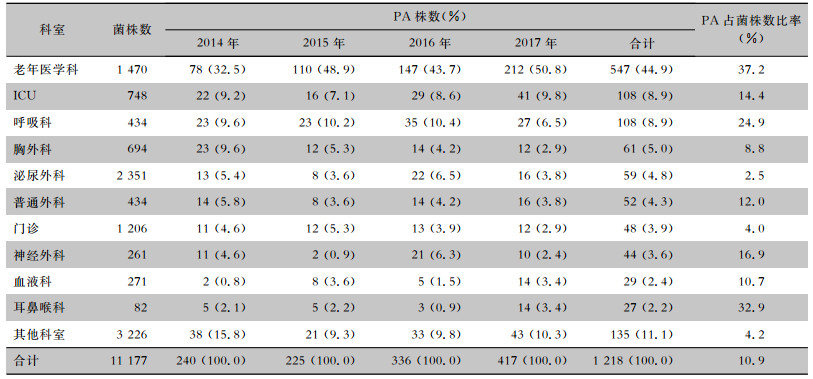
|
1 218株PA中,952株(78.2%)分离自男性患者。81~90岁年龄段是PA最多见的分离人群(319株,26.2%),其次为>90、61~70、71~80岁年龄段人群,分别占21.3%、19.0%、12.7%。男性患者分离菌株数随年龄变化采用幂函数曲线拟合,结果显示随年龄增长菌株分离率显著上升(P < 0.001);女性患者采用二次函数曲线拟合,结果显示随年龄增长菌株分离率也增长(P=0.045),并在61~70岁年龄段后呈现下降趋势。见图 2。
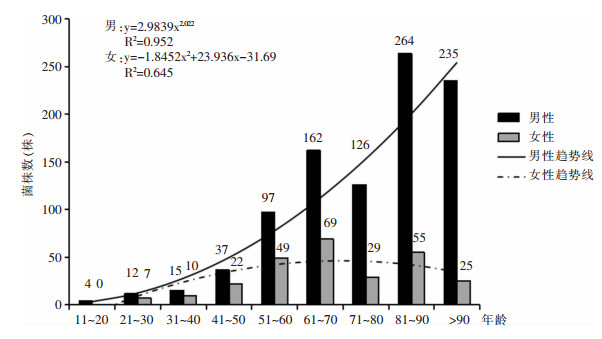 |
| 图 2 2014—2017年PA在不同年龄和性别患者中的变化趋势 Figure 2 Changing trend of PA in patients of different ages and sexes from 2014 to 2017 |
2014—2017年PA菌株中,MDR-PA、XDR-PA、CRPA分离率分别为30.5%、2.5%、38.8%,均以2017年分离率最高,分别为35.7%、4.3%和47.5%。此外,4年间痰标本中MDR-PA、CRPA的分离率均高于非痰标本(均P<0.05),但XDR-PA则差异无统计学意义(P>0.05)。见表 3。MDR-PA、XDR-PA和CRPA分布均以痰(分别为85.5%、76.6%和83.5%)、尿(分别为6.5%、10.0%和7.6%)为主,临床科室分布以老年医学科(分别为63.2%、46.7%和56.9%)和呼吸科(分别为11.3%、16.7%和9.9%)最常见。见表 4。
| 表 3 2014—2017年MDR-PA、XDR-PA、CRPA分离情况[株(%)] Table 3 Isolation of MDR-PA, XDR-PA and CRPA from 2014 to 2017 (No. of isolates[%]) |

|
| 表 4 2014—2017年MDR-PA、XDR-PA、CRPA标本及科室来源分布[株数(%)] Table 4 Distribution of MDR-PA, XDR-PA, and CRPA specimens and departments sources from 2014 to 2017 (No. of isolates[%]) |

|
本研究中,PA痰中检出最多,与呼吸道为其常见的感染部位结果[9-10]一致,可能与PA易于定植呼吸道有关。当机体免疫力下降时,细菌侵袭,损伤肺部机能,痰液难以排出,导致PA积聚并大量繁殖[11]。尿标本PA分离率仅次于痰,提示该菌也易引起尿路感染[9],可能与尿潴留、尿路结石、生殖系统病变及留置导尿管等高危因素有关[12]。
PA在老年医学科检出率居首位,可能与老年患者机体基础条件差、长期卧床、病情复杂及常伴有多器官功能衰竭有关。另外,长期抗菌药物和糖皮质激素治疗破坏机体免疫系统,病房环境复杂导致多种病原菌交叉传播,以及反复感染也是老年科PA多见的可能因素。ICU患者起病急、病情重及长期大剂量使用抗菌药物,导致人体正常菌群紊乱并筛选出耐药菌株,与该科PA分离率偏高有关[13]。呼吸科患者多有肺部功能受损,致使细菌清除能力下降,加上机械通气等创伤性治疗措施破坏患者自身防御机制,为PA生存提供了合适的环境[9],与本研究该科PA分离率较高一致。另外,本研究显示,PA更易分离于老年男性患者,其原因可能与男女间卫生习惯、皮肤表面细菌数量和种类差异,以及老年患者免疫功能弱、感染愈后差有关[14-15]。
PA具有快速获得多重耐药的能力,使该菌感染具有较高的发病率和病死率,且治疗困难[2]。PA耐药机制比较复杂,常见的有产头孢菌素酶和β-内酰胺酶、外膜通透性降低、产磷酸转移酶和乙酰转移酶、拓扑异构酶Ⅱ和Ⅳ改变、主动外排系统过表达等[2]。当前,PA多重耐药菌株已在世界范围内流行,欧洲30个国家参与的抗菌药物耐药监测数据显示,MDR-PA的分离率为0~49.4%,其中16个国家<10%,11个国家为10%~25%,3个国家>25%;美国MDR-PA占13%~19%,伊朗MDR-PA平均分离率高达58%[16-17]。尽管国内有MDR-PA的报道,但CHINET中国细菌耐药监测网并没有关于MDR-PA的相关数据[8, 18]。本研究中,MDR-PA占30.5%,此数据低于韩国(50%)、土耳其(60%)、埃及(36%)和印度(36.2%)[2]。另外,本文中XDR-PA占2.5%,尽管比率较低,但呈逐年递增趋势,提示在本院治疗PA时需要密切关注抗菌药物的合理使用。过渡使用广谱抗菌药物也容易导致全耐药(pan-drug resistance,PDR)菌株的产生。CHINET PA耐药性监测数据显示,PDR-PA的分离率为0.9%~1.7% [9, 18]。本研究虽因个别抗菌药物未能进行常规药敏试验而不能统计PDR-PA的发生率,但30.5%的MDR-PA和2.5%的XDR-PA提示PDR-PA存在的可能性很大。本研究中CRAP的检出率为38.8%[亚胺培南耐药率为27.3%,美罗培南耐药率为24.7%],高于2017年CHINET监测网数据(亚胺培南耐药率为23.6%和美罗培南耐药率为20.9%)[18],因此使用该类药物治疗PA感染时应严格监测CRAP分离情况。
文献[19-20]显示,磷霉素和多粘菌素类药物联用对PA具有协同杀灭作用,可能成为治疗MDR-PA、XDR-PA、CRPA感染的新思路。多粘菌素是治疗XDR-PA的少数可供选择的抗生素,绝大部分菌株对其敏感,由于该药敏感性检测必须测其MIC值,故本院未能常规开展其敏感性试验。2017年CHINET监测网数据中PA对多粘菌素耐药率为0.9%,尽管很低,但表明临床已经存在对该药耐药的PA。
本研究显示,MDR-PA、XDR-PA、CRPA尤其多见于痰标本,可能是痰标本多来自于基础疾病严重患者较多的病区,如老年医学科、呼吸科、神经外科等,复杂感染长期使用抗菌药物,导致筛选出耐药菌株;而非痰标本多为尿和无菌体液,所处环境较单一,发生筛选和交叉感染的概率相对较低[18]。另外,PA具有荚膜多糖,极易定植于呼吸道,而临床上多采集患者痰标本送检,检出PA后即使用抗菌药物治疗,导致菌株耐药筛选压力进一步加重。
综上所述,本院MDR-PA、CRPA分离率高,在今后的临床工作中,应强化医务人员医院感染防控意识,加强医院感染防控,根据药敏试验结果选药和使用新型抗菌药物治疗,以减少MDR-PA、XDR-PA、CRPA的产生与传播。另外,针对磷霉素和多粘菌素类药物应常规开展药敏试验,以弥补实验室对临床用药选择支撑不足的缺陷。
| [1] |
王琰琰. 耐碳青霉烯类铜绿假单胞菌感染相关因素分析[J]. 四川生理科学杂志, 2019, 41(2): 138-140. |
| [2] |
Hosseininassab Nodoushan SA, Yadegari S, Moghim S, et al. Distribution of the strains of multidrug-resistant, extensively drug-resistant, and pandrug-resistant Pseudomonas aeruginosa isolates from burn patients[J]. Adv Biomed Res, 2017, 6: 74. |
| [3] |
Vingopoulou EI, Delis GA, Batzias GC, et al. Prevalence and mechanisms of resistance to fluoroquinolones in Pseudomonas aeruginosa and Escherichia coli isolates recovered from dogs suffering from otitis in Greece[J]. Vet Microbiol, 2018, 213: 102-107. |
| [4] |
Subedi D, Vijay AK, Willcox M. Overview of mechanisms of antibiotic resistance in Pseudomonas aeruginosa: an ocular perspective[J]. Clin Exp Optom, 2018, 101(2): 162-171. |
| [5] |
苏冬梅, 黄燕, 刘一, 等. 铜绿假单胞菌血流感染多重耐药患者临床特征分析[J]. 解放军医学院学报, 2017, 38(2): 136-139. |
| [6] |
Zubair KO, Iregbu KC. Resistance pattern and detection of metallo-beta-lactamase genes in clinical isolates of Pseudomonas aeruginosa in a central Nigeria tertiary hospital[J]. Niger J Clin Pract, 2018, 21(2): 176-182. |
| [7] |
尚红, 王毓三, 申子瑜.全国临床检验操作规程[M]. 4版.北京: 人民卫生出版社, 2015: 650-653.
|
| [8] |
李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义—国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64. |
| [9] |
张祎博, 孙景勇, 倪语星, 等. 2005—2014年CHINET铜绿假单胞菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 141-145. |
| [10] |
姚伟梅, 程绕, 杜倩, 等. 铜绿假单胞菌医院感染的调查与耐药性分析[J]. 中华医院感染学杂志, 2017, 27(21): 4819-4821, 4841. |
| [11] |
左淑兰, 李娟. 老年急性脑梗死患者并发下呼吸道感染的病原菌监测及耐药性[J]. 中国老年学杂志, 2019, 39(1): 32-34. |
| [12] |
孙涛, 贾洪涛, 王秀新, 等. 复杂性尿路感染的病原菌分布及革兰阴性杆菌的耐药性分析[J]. 国际泌尿系统杂志, 2018, 38(2): 237-240. |
| [13] |
税剑, 邹明祥, 李军, 等. 某院2016年ICU与普通病房铜绿假单胞菌耐药性对比分析[J]. 中国感染控制杂志, 2018, 17(1): 6-9. |
| [14] |
李代昆, 李具琼, 余雪梅, 等. 黏液型铜绿假单胞菌临床分布与耐药性分析[J]. 中华医院感染学杂志, 2017, 27(12): 2645-2648. |
| [15] |
张静, 陈泽涛, 刘永贤. 老年患者感染铜绿假单胞菌的相关因素及耐药情况分析[J]. 实用心脑肺血管病杂志, 2018, 26(5): 85-87. |
| [16] |
Vaez H, Salehi-Abargouei A, Ghalehnoo ZR, et al. Multidrug resistant Pseudomonas aeruginosa in Iran: a systematic review and meta analysis[J]. J Glob Infect Dis, 2018, 10(4): 212-217. |
| [17] |
Raman G, Avendano EE, Chan J, et al. Risk factors for hospitalized patients with resistant or multidrug-resistant Pseudomonas aeruginosa infections: a systematic review and meta-analysis[J]. Antimicrob Resist Infect Control, 2018, 7: 79. |
| [18] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [19] |
王颖, 宋宁, 李继红. 磷霉素治疗铜绿假单胞菌感染研究进展[J]. 河北医科大学学报, 2018, 39(9): 1112-1116. |
| [20] |
徐溯, 杨帆. 耐药形势下磷霉素的临床应用[J]. 中国感染与化疗杂志, 2018, 18(4): 434-439. |



