2. 上海交通大学附属第一人民医院血液科, 上海 200080;
3. 上海交通大学医学院附属瑞金医院血液科, 上海 200025;
4. 上海交通大学医学院附属仁济医院血液科, 上海 200135;
5. 复旦大学附属中山医院血液科, 上海 200032;
6. 同济大学附属第十人民医院血液科, 上海 200072;
7. 同济大学附属同济医院血液科, 上海 200333;
8. 上海长征医院血液科, 上海 201705;
9. 复旦大学附属上海市第五人民医院血液科, 上海 200240;
10. 上海交通大学医学院附属第九人民医院血液科, 上海 200011;
11. 上海市杨浦区市东医院血液科, 上海 200433;
12. 上海市嘉定区中心医院血液科, 上海 201807
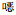 唑敏感率>90%,鲍曼不动杆菌对阿米卡星、头孢哌酮/舒巴坦的耐药率低于10%。耐甲氧西林金黄色葡萄球菌(MRSA)检出率为71.4%,未发现耐万古霉素、替考拉宁、利奈唑胺的金黄色葡萄球菌。结论 粒缺伴肺部感染患者呼吸道分泌物分离菌株以革兰阴性菌占多数,其中非发酵菌占50%以上,细菌耐药率整体低于CHINET全国医院大样本监测结果。
唑敏感率>90%,鲍曼不动杆菌对阿米卡星、头孢哌酮/舒巴坦的耐药率低于10%。耐甲氧西林金黄色葡萄球菌(MRSA)检出率为71.4%,未发现耐万古霉素、替考拉宁、利奈唑胺的金黄色葡萄球菌。结论 粒缺伴肺部感染患者呼吸道分泌物分离菌株以革兰阴性菌占多数,其中非发酵菌占50%以上,细菌耐药率整体低于CHINET全国医院大样本监测结果。2. Department of Hematology, Shanghai General Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 200080, China;
3. Department of Hematology, Ruijin Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China;
4. Department of Hematology, Renji Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200135, China;
5. Department of Hematology, Zhongshan Hospital Affiliated to Fudan University, Shanghai 200032, China;
6. Department of Hematology, Shanghai Tenth People's Hospital Affilia-ted to Tongji University, Shanghai 200072, China;
7. Department of Hematology, Tongji Hospital Affiliated to Tongji University, Shanghai 200333, China;
8. Department of Hematology, Shanghai Changzheng Hospital, Shanghai 201705, China;
9. Department of Hematology, The Fifth People's Hospital of Shanghai, Fudan University, Shanghai 200240, China;
10. Department of Hematology, The Ninth People's Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China;
11. Department of Hematology, Shanghai Yangpu District East Hospital, Shanghai 200433, China;
12. Department of Hematology, Shanghai Jiading District Central Hospital, Shanghai 201807, China
中性粒细胞缺乏(粒缺)继发感染是血液病化学治疗(化疗)患者最主要的死亡原因。肺部感染是此类患者常见的感染,治疗难度大,致死率高。根据美国感染病协会指南[1],大多数粒缺患者感染部位和病原菌不明确,仅20%~30%的患者可确定感染部位和感染病原体,常见的感染部位包括胃肠道、肺和皮肤。在我国粒缺伴发热的患者中,能够明确感染部位者占54.7%,其中最常见的感染部位是肺,其次依次是上呼吸道、肛周和血液等[2]。与其他部位的感染相比,粒缺伴肺部感染的患者死亡率更高[3-4],治疗难度更大,治疗费用更高[5]。按照粒缺伴发热的危险度分层,出现新发肺部感染的患者属于高危组,需要住院积极治疗[1]。影像学检查确定肺部感染后,呼吸道分泌物培养可以明确病原菌,指导抗菌药物使用的调整。为此,本研究对上海地区粒缺伴发热肺部感染血液病患者的呼吸道分泌物检出病原菌分布及耐药情况进行分析,以期为临床经验性抗感染治疗方案的选择提供科学依据。
1 对象与方法 1.1 菌株来源菌株来自于2012年1月—2014年12月12所医院血液科粒缺发热伴肺部感染住院患者的呼吸道分泌物标本,包括上海交通大学医学院附属新华医院、上海交通大学附属第一人民医院、上海交通大学医学院附属瑞金医院、上海交通大学医学院附属仁济医院、复旦大学附属中山医院、同济大学附属第十人民医院、同济大学附属同济医院、上海长征医院、复旦大学附属上海市第五人民医院、上海交通大学医学院附属第九人民医院、上海市杨浦区市东医院、上海市嘉定区中心医院。
1.2 相关定义及诊断标准粒细胞缺乏伴发热是指口腔单次温度≥38.3℃或≥38℃持续超过1 h,且中性粒细胞绝对值<0.5×109/L或<1.0×109/L,在未来24~48 h内<0.5×109/L;排除粒细胞缺乏前存在感染引起的发热[1]。肺部感染的诊断标准参考医院获得性肺炎的诊断标准,即胸部X线片或胸部CT证实的新出现的肺部浸润表现,伴有至少以下一项:新出现的咳嗽,原有咳嗽加重,伴有咳痰,发热[6]。
1.3 纳入和排除标准纳入标准:同时满足如下条件,血液病患者、粒细胞缺乏伴有发热、临床考虑肺部感染所致发热、呼吸道分泌物培养分离出致病菌。同一患者多次呼吸道分泌物培养阳性时,相同菌选择第一菌株。排除标准:未发生粒细胞缺乏的血液病患者,考虑其他部位感染所致发热的患者,呼吸道分泌物培养未分离出致病菌的患者。所有患者对本研究均知情同意,签署知情同意书,并通过医院伦理委员会批准。
1.4 资料收集方式及质量控制由临床医生填写“血液科粒缺伴发热患者信息收集表”,其内容包括患者的一般特点、诊断类型、体温、是否有新发肺部浸润表现等。所有患者呼吸道分泌物送上海市第一人民医院检验科微生物室统一进行菌株鉴定及药敏试验,以确保试验结果的一致性及可靠性。
1.5 菌株鉴定及药敏试验采用法国生物梅里埃公司VITEK 2 Compact细菌鉴定系统鉴定细菌。分离菌株采用纸片扩散法(K-B法)进行药敏试验,用WHONET 5.6软件分析菌株的分布及药敏特点。质控菌株为金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、肺炎链球菌ATCC 49619和流感嗜血杆菌ATCC 49247,遵循美国临床实验室标准化协会(CLSI)2014版标准进行判断。
1.6 统计方法应用SAS 9.2统计软件对数据进行分析,计量资料采用均数±标准差(x±s)表示,计数资料以例数或百分比(%)表示。计量资料的比较采用方差检验,计数资料的比较采用卡方检验,以P≤0.05为差异有统计学意义。
2 结果 2.1 基本资料共分离病原菌623株,来自490例患者,其中男性255例,女性235例;年龄12~86岁,平均(52.53±13.9)岁。原发疾病为急性髓系白血病257例,急性淋巴细胞白血病105例,淋巴瘤51例,骨髓瘤42例,其他血液病35例,部分患者多次住院治疗。四种疾病性别分布之间比较,差异无统计学意义(χ2=1.534,P>0.05)。不同类型血液病患者年龄比较,差异有统计学意义(F=34.8,P<0.05),急性淋巴细胞白血病患者的年龄低于急性髓系白血病、淋巴瘤和骨髓瘤患者(P<0.05)。不同类型血液病患者粒细胞数比较,差异有统计学意义(F=23.94,P<0.05),急性髓系白血病和急性淋巴细胞白血病患者粒细胞数低于淋巴瘤和骨髓瘤患者(P<0.05)。发热至标本采集时间各组之间比较,差异无统计学意义(F=4.23,P>0.05)。见表 1。
| 表 1 490例粒缺伴肺部感染血液病患者的基本资料 Table 1 Basic information of 490 hematological patients with agranulocytosis accompanied by pulmonary infection |
|
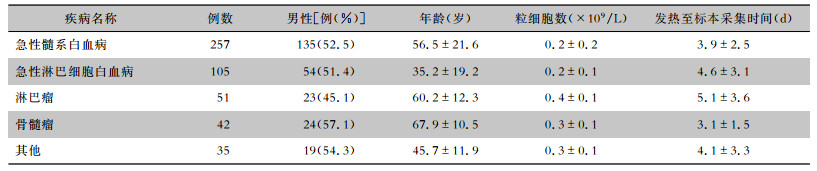
623株病原菌以革兰阴性菌多见(485株,占77.8%),革兰阳性菌138株(占22.2%)。病原菌主要分离自急性髓系白血病患者(52.0%),其次为急性淋巴细胞白血病患者、淋巴瘤患者,分别占22.5%、9.6%。在各疾病间,革兰阳性和革兰阴性菌分布上差异有统计学意义(χ2=7.73,P=0.021),见表 2。淋巴瘤患者标本中分离革兰阳性菌占比高于急性髓系白血病患者、急性淋巴细胞白血病患者(χ2值分别为4.50、7.68,P < 0.05)。非发酵菌292株,占革兰阴性菌的60.2%。
| 表 2 不同粒缺伴肺部感染血液病患者呼吸道分泌物标本分离病原菌分布情况 Table 2 Distribution of pathogens isolated from respiratory secretion of hematological patients with different agranulocytosis accompanied by pulmonary infection |
|
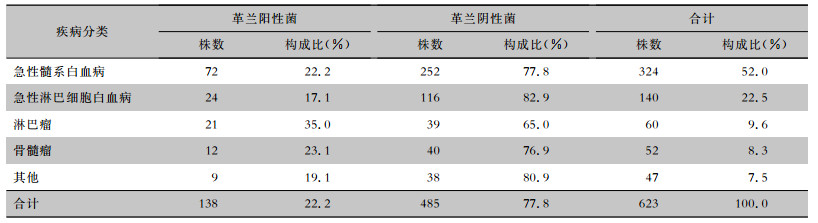
居前5位的细菌依次是嗜麦芽窄食单胞菌(16.7%)、肺炎克雷伯菌(14.1%)、鲍曼不动杆菌(10.0%)、铜绿假单胞菌(9.0%)、金黄色葡萄球菌(7.7%)。其中嗜麦芽窄食单胞菌和肺炎克雷伯菌均常见于急性髓系白血病、急性淋巴细胞白血病、淋巴瘤和骨髓瘤四种血液肿瘤,但其分布差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 粒缺伴肺部感染血液病患者呼吸道分泌物标本分离居前5位的病原菌分布 Table 3 Distribution of the top five pathogens isolated from respiratory secretion of hematological patients with agranulocytosis accompanied by pulmonary infection |
|
革兰阴性菌中,肺炎克雷伯菌对亚胺培南和美罗培南等碳青霉烯类抗生素的耐药率低于2%,对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、阿米卡星的耐药率低于15%;嗜麦芽窄食单胞菌对米诺环素、左氧氟沙星、复方磺胺甲
| 表 4 主要革兰阴性菌对常见抗菌药物的药敏结果 Table 4 Antimicrobial susceptibility testing results of major gram-negative bacteria |
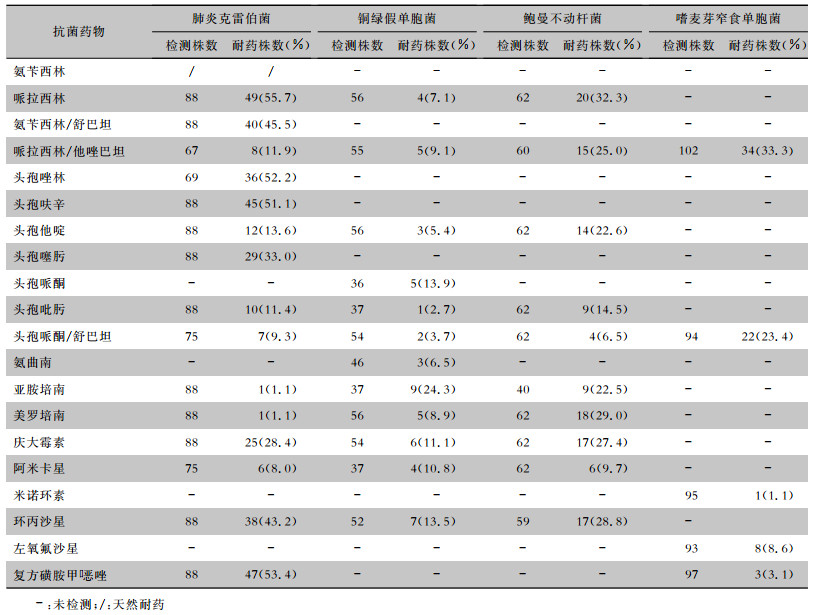
|
| 表 5 金黄色葡萄球菌对常用抗菌药物的药敏结果 Table 5 Antimicrobial susceptibility testing results of Staphylococcus aureus |
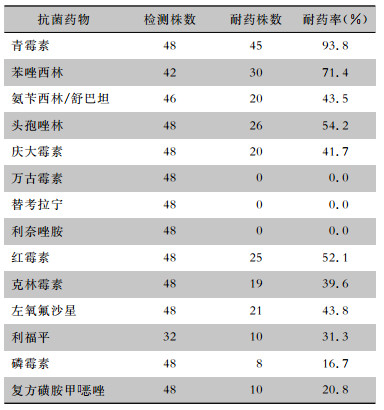
|
血液疾病常累及粒细胞或淋巴细胞,导致免疫功能低下,化疗后常出现粒细胞缺乏伴黏膜损伤,进一步增加感染的发病率。呼吸道作为与外界相通的组织器官,在粒细胞缺乏及呼吸道黏膜受累的情况下,外界或定植细菌容易增殖导致上呼吸道感染,进一步可引起肺部感染。根据德国血液肿瘤感染指南[7],15%~28%化疗后粒缺的患者出现肺部浸润,且2/3的患者发热后5 d会出现明显的肺部浸润表现,如肺部感染、肺泡出血、免疫性肺炎、肿瘤肺部浸润和放化疗引起的肺损伤等,其中肺部感染是肺部浸润的主要原因。对于粒缺肺部感染的患者,在呼吸道分泌物培养结果出来前,需要及时经验性抗菌药物治疗。一项包括3 219例粒缺发热患者的研究中,87.6%为血液肿瘤患者,发热后2 h使用抗菌药物的患者30天病死率为5%,而24 h后开始使用抗菌药物患者,其30天病死率高达13%(P < 0.01)[8]。由于经验性应用广谱抗菌药物,病原菌的选择性耐药明显增加[9]。在病原学结果出来之前,及时、准确、规范地使用抗菌药物不但可降低粒缺发热患者的病死率,并且有助于减少细菌耐药[10]。经验性抗菌药物的选择,需要充分考虑治疗单位所在地区的最新病原学分布及药敏特点[11]。
本研究分离的623株病原菌,革兰阴性菌占77.8%,与全国CHINET数据[12]相当,提示初始经验性治疗首先选择针对革兰阴性菌的药物。值得注意的是,革兰阴性菌中非发酵菌占60.2%,其中嗜麦芽窄食单胞菌是最常见的致病菌,占16.7%,远高于全国同期水平(5.6%)[12]。嗜麦芽窄食单胞菌对碳青霉烯类抗生素天然耐药,其高感染率考虑与碳青霉烯类抗生素的广泛使用相关。对于粒缺肺部感染的血液病患者,使用广谱抗菌药物治疗后仍发热的患者,需要考虑嗜麦芽窄食单胞菌感染的可能,可经验性选择相关敏感抗菌药物治疗。分析不同血液病患者呼吸道分泌物分离菌,发现淋巴瘤患者革兰阳性菌占35%,高于急性髓系白血病(22.2%)和急性淋巴细胞白血病(17.1%)患者,提示对于淋巴瘤患者出现粒缺伴肺部感染时,需要重视革兰阳性菌感染。
对呼吸道分泌物常见细菌耐药性进行分析,发现嗜麦芽窄食单胞菌对左氧氟沙星、复方磺胺甲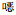
呼吸道分泌物的培养不可避免地存在污染和定植问题[13]。本研究无法确定污染和定植率,但可从两个方面降低污染和定植率,一方面加强呼吸道分泌物的规范留取、送检和培养过程,另一方面可开展支气管肺泡灌洗(bronchoalveolar lavage,BAL)检查[14]。由于血液系统疾病除伴有粒细胞缺乏外,常合并血小板减少和凝血功能异常,血液科和呼吸科医生对于开展血液系统疾病患者BAL检查常存在顾虑。一项回顾性研究[15]显示,249例血液肿瘤患者接受BAL检查,3例(1.2%)患者出现出血等非致死性并发症导致检查终止,94例(38.2%)患者根据灌洗液培养结果调整抗菌药物的使用。然而,在另一项前瞻性随机对照研究[16]中,220例血液肿瘤患者因急性呼吸衰竭入住重症监护病房,随机接受BAL检查或非侵入性检查,发现BAL检查并没有降低气管插管率(35.4% VS 38.7%,P=0.62),28天死亡率亦无明显差别(29.2% VS 33%,P=0.56)。根据德国血液肿瘤感染指南,BAL列为B-Ⅲ类证据,建议合适的患者接受BAL检查[7]。
综上所述,上海地区粒缺发热伴肺部感染血液病患者呼吸道分泌物分离细菌有其特点,以革兰阴性菌占多数,其中非发酵菌占50%以上,非发酵菌中以嗜麦芽窄食单胞菌为主。对常见细菌的药敏分析发现,革兰阴性菌对常用抗菌药物的耐药率普遍优于全国平均监测水平,可能与血液病房对抗菌药物的使用相对规范有关。
| [1] |
Freifeld AG, Bow EJ, Sepkowitz KA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 Update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2011, 52(4): 427-431. DOI:10.1093/cid/ciq147 |
| [2] |
中华医学会血液学分会, 中国医师协会血液科医师分会. 中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2016年版)[J]. 中华血液学杂志, 2016, 37(5): 353-359. |
| [3] |
Azoulay E, Thiéry G, Chevret S, et al. The prognosis of acute respiratory failure in critically ill cancer patients[J]. Medicine (Baltimore), 2004, 83(6): 360-370. DOI:10.1097/01.md.0000145370.63676.fb |
| [4] |
闫晨华, 徐婷, 郑晓云, 等. 中国血液病患者中性粒细胞缺乏伴发热的多中心、前瞻性流行病学研究[J]. 中华血液学杂志, 2016, 37(3): 177-182. |
| [5] |
Kuderer NM, Dale DC, Crawford J, et al. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients[J]. Cancer, 2006, 106(10): 2258-2266. DOI:10.1002/cncr.21847 |
| [6] |
Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis, 2016, 63(5): e61-e111. DOI:10.1093/cid/ciw353 |
| [7] |
Maschmeyer G, Carratala J, Buchheidt D, et al. Diagnosis and antimicrobial therapy of lung infiltrates in febrile neutropenic patients (allogeneic SCT excluded): updated guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Medical Oncology (DGHO)[J]. Ann Oncol, 2015, 26(1): 21-33. DOI:10.1093/annonc/mdu192 |
| [8] |
Daniels LM, Durani U, Barreto JN, et al. Impact of time to antibiotic on hospital stay, intensive care unit admission, and mortality in febrile neutropenia[J]. Support Care Cancer, 2019, 27(11): 4171-4177. DOI:10.1007/s00520-019-04701-8 |
| [9] |
Alp S, Akova M. Management of febrile neutropenia in the era of bacterial resistance[J]. Ther Adv Infect Dis, 2013, 1(1): 37-43. |
| [10] |
Mebis J, Goossens H, Berneman ZN. Antibiotic management of febrile neutropenia: current developments and future directions[J]. J Chemother, 2010, 22(1): 5-12. DOI:10.1179/joc.2010.22.1.5 |
| [11] |
Kontoyiannis DP, Lewis RE, Marr K. The burden of bacterial and viral infections in hematopoietic stem cell transplant[J]. Biol Blood Marrow Transplant, 2009, 15(Suppl 1): 128-133. |
| [12] |
杨青, 俞云松, 林洁, 等. 2005—2014年CHINET呼吸道分离菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(5): 541-550. |
| [13] |
Dettenkofer M, Wenzler-Rottele S, Babikir R, et al. Surveillance of nosocomial sepsis and pneumonia in patients with a bone marrow or peripheral blood stem cell transplant: a multicenter project[J]. Clin Infect Dis, 2005, 40(7): 926-931. DOI:10.1086/428046 |
| [14] |
Svensson T, Lundstrom KL, Hoglund M, et al. Utility of bronchoalveolar lavage in diagnosing respiratory tract infections in patients with hematological malignancies: are invasive diagnostics still needed?[J]. Ups J Med Sci, 2017, 122(1): 56-60. DOI:10.1080/03009734.2016.1237595 |
| [15] |
Hummel M, Rudert S, Hof H, et al. Diagnostic yield of bronchoscopy with bronchoalveolar lavage in febrile patients with hematologic malignancies and pulmonary infiltrates[J]. Ann Hematol, 2008, 87(4): 291-297. DOI:10.1007/s00277-007-0391-6 |
| [16] |
Azoulay E, Mokart D, Lambert J, et al. Diagnostic strategy for hematology and oncology patients with acute respiratory failure: randomized controlled trial[J]. Am J Respir Crit Care Med, 2010, 182(8): 1038-1046. DOI:10.1164/rccm.201001-0018OC |



