血液系统疾病特别是恶性血液病患者化学治疗前后常常合并中性粒细胞缺乏,极易发生各种感染,严重者可导致死亡[1]。随着抗菌药物的大量使用,革兰阳性(G+)菌感染发生率逐年增高,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)检出率明显增加[2]。达托霉素为环脂肽类抗生素,对MRSA作用快速,被美国食品药品监督管理局(FDA)批准用于治疗复杂性皮肤软组织感染(cSSTI)。本研究对山西医科大学附属山西大医院血液科2018年3月—2019年3月采用达托霉素治疗的18例血液病合并皮肤软组织感染(SSTI)的患者进行评估,分析达托霉素治疗血液病合并SSTI的临床疗效及安全性。
1 对象与方法 1.1 研究对象2018年3月—2019年3月山西医科大学附属山西大医院血液科住院并使用达托霉素治疗的血液病合并SSTI患者。
1.2 方法 1.2.1 资料收集回顾性收集患者临床数据,包括一般情况、原发疾病、感染类型、感染病原体、达托霉素的应用方案和疗效、合并用药情况、不良事件等。
1.2.2 判定标准按照中国医师协会皮肤科分会制定的《皮肤及软组织感染诊断和治疗共识》[3]:存在明显的基础疾病,或有明确的创伤(包括咬伤)等并发的SSTI。粒细胞缺乏症的诊断标准:中性粒细胞绝对值<0.5×109/L。
1.2.3 相关指标的评价临床疗效评价采用2014年国家食品药品监督管理总局(CFDA)颁布的《抗菌药物临床试验技术指导原则》[4]评价临床疗效,疗效评价分为临床治愈和临床无效。不良反应评价:安全性评价按世界卫生组织(WHO)国际药物监测中心可疑不良反应指标分为“肯定有关、很可能有关、可能有关、可能无关和无关”评定,前3者计为药物的不良反应。密切观察与用药有关的不良反应,如肌肉酸痛、肌酸激酶(CK)增高、内生肌酐清除率下降、胃肠道反应(恶心、呕吐、腹泻、便秘)、头痛、注射部位不适等。
1.3 统计学分析应用SPSS 25.0统计软件分析。计量资料为非正态分布,以中位数表示,计数资料以百分率表示,率的比较采用χ2检验,以P≤0.05为差异具有统计学意义。
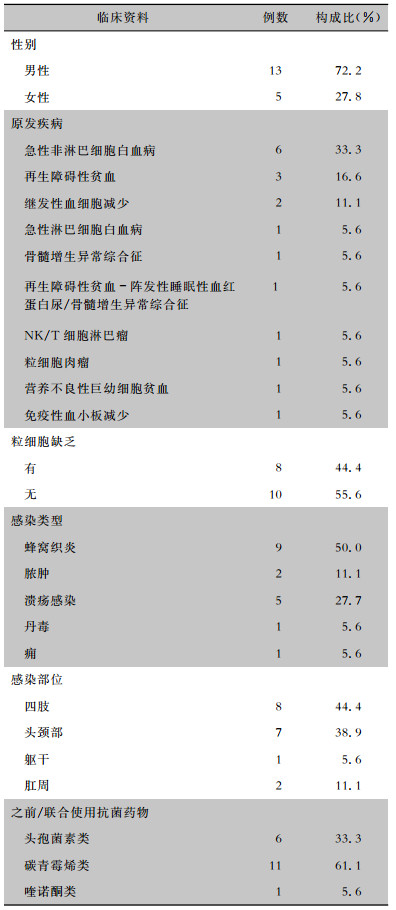
2 结果 2.1 感染类型及临床特征血液病合并SSTI使用达托霉素治疗的患者共18例,其中男性13例,女性5例,中位年龄36(11~77)岁。患者原发疾病以急性髓系白血病(6例)、再生障碍性贫血(3例)、继发性血细胞减少(2例)为主,有8例患者存在粒细胞缺乏。18例患者在原有血液病基础上合并的蜂窝织炎、脓肿、溃疡感染、丹毒、痈, 均属于cSSTI。所有患者均多次行血、感染部位分泌物、脓液培养。由于患者之前或同时存在其他部位感染, 因此,在达托霉素抗感染治疗基础上,之前/联合使用其他抗菌药物。18例血液病合并SSTI患者基本资料见表 1。
| 表 1 18例血液病合并SSTI患者基本资料 Table 1 Basic data of 18 patients with hematopathy and SSTI |
|
18例血液病合并SSTI患者中性粒细胞绝对计数为(0.03~16.35)×109/L。1例臀部脓肿患者脓液培养为金黄色葡萄球菌,其余17例患者血培养及感染部位分泌物、脓液培养均为阴性。
2.3 合并使用抗菌药物18例患者均在使用达托霉素治疗前或同时使用至少1种其他抗菌药物,最常见的为碳青霉烯类、第三/四代头孢菌素类及喹诺酮类。
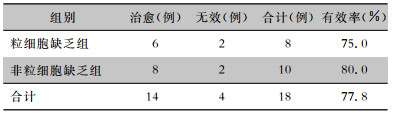
2.4 临床疗效采用达托霉素0.5 g,qd, 静脉滴注,中位疗程10(1~19) d;18例患者治愈14例,无效4例,临床有效率77.8%。其中,粒细胞缺乏组患者临床有效率为75.0%,非粒细胞缺乏组患者的临床有效率为80.0%,两组比较差异无统计学意义(P>0.05)。见表 2。治疗有效的患者中,皮肤软组织红肿、热痛及破溃渗出症状均得到改善或完全愈合,体温明显下降或恢复正常。体温下降1℃的中位时间为12(4~24) h,退热中位时间1.7(0.2~4) d。
| 表 2 粒细胞缺乏组与非粒细胞缺乏组患者达托霉素疗效比较 Table 2 Comparison of treatment efficacy of daptomycin between patients in agranulocytosis group and non-agranulocytosis group |
|
在应用达托霉素期间,未观察到与该药相关的肌肉酸痛、CK增高、内生肌酐清除率下降、腹泻、便秘、注射部位不适等不良反应。
3 讨论多数血液病患者, 尤其是恶性血液病患者粒细胞缺乏、免疫功能缺陷、长期使用抗菌药物、化学治疗后黏膜破损、深静脉导管留置等,均是G+菌感染的高危因素。SSTI中最常见的是G+感染,在医院SSTI中,MRSA感染发病率逐年上升[5]。过去万古霉素被认为是G+菌感染包括MRSA感染的标准治疗方案[2],但随着万古霉素对其最低抑菌浓度(MIC)逐渐增加且作用缓慢,使用起效快、抗菌作用强且能克服耐药的杀菌药物显得尤为重要。
达托霉素是首个被发现的环脂肽类抗生素,对需氧及厌氧甲氧西林敏感金黄色葡萄球菌(MSSA)、MRSA、耐万古霉素肠球菌(VRE)、耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)等均有杀灭作用。其杀菌机制为:(1)插入细胞膜,依赖Ca2+与G+菌细胞膜不可逆结合;(2)泵出K+,改变离子浓度梯度使细胞膜快速去极化, 通过抑制DNA、RNA和蛋白质合成,破坏细菌生物系统导致细菌非溶解性死亡。独特的作用机制使之与其他抗菌药物无交叉耐药性,且对多重耐药G+菌有很好的杀灭作用[6],对静止期的细菌同样具有较强的杀菌活性[7]。达托霉素为剂量依赖性抗生素[8],主要分布在血流丰富的脏器,对G+菌血流感染和导管相关感染作用较强[9-10]。
随着G+菌对经典抗菌药物耐药不断增高,达托霉素作为治疗G+球菌感染的抗生素有极其重要的作用。目前,G+球菌对达托霉素的耐药率极低,包括金黄色葡萄球菌、凝固酶阴性葡萄球菌、肠球菌及溶血性链球菌,特别是多重耐药G+球菌。研究[11]发现,达托霉素对MRSA和万古霉素不敏感的金黄色葡萄球菌(hVIsA)产生快速有效的杀灭作用,而万古霉素在高剂量时对MRSA显示微弱而缓慢的杀菌作用,对hVISA抗菌活性微弱或无作用。对于万古霉素治疗失败的G+球菌感染患者使用达托霉素治疗有效率仍高达97.0%,尽管达托霉素对某些G+球菌MIC会升高,但其对菌血症患者血中G+球菌仍有清除作用[12]。因此,对于cSSTI患者达托霉素已成为首选治疗方案。达托霉素作为重症G+球菌感染的二线治疗方案,本研究中11%的患者在使用达托霉素治疗前曾接受过糖肽类抗生素,如万古霉素治疗,因治疗失败而更换为达托霉素治疗。
研究[13]证实,达托霉素对于SSTI治疗的有效性和安全性不亚于标准疗法(万古霉素或耐碳青霉素类)。一项Meta分析纳入1 710例随机对照临床实验,结果显示达托霉素对比其他一线药物(万古霉素、替考拉宁、半合成青霉素)治疗SSTI疗效和不良反应的非劣效性[5]。2015年欧洲一项多中心非干预性观察,纳入达托霉素治疗患者6 075例,感染类型包括cSSTI、血流感染、感染性心内膜炎、骨髓炎及整形外科假体感染,临床总有效率为80.5%,其中SSTI临床有效率为84.7%[14]。一项纳入美国、欧洲、拉丁美洲、亚洲11 577例患者的综合研究[15]显示,达托霉素的临床总有效率为77.2%,其中对于SSTI临床有效率为81.0%。日本一项多中心Ⅲ期研究发现, 在由MRSA引起的SSTI患者中,81.8%(95%CI:69.1~90.9)的达托霉素受试者取得了成功的临床反应[6]。来自中国的一项多中心研究[16]纳入203例使用达托霉素治疗的患者,发现总体治疗有效率为70.44%,具有较好的安全性和耐受性以及较低的治疗失败率,此数据与欧洲(89%)、美国(71.5%)及巴西(80.8%)的评估数据相似[17-18]。一项多中心回顾性观察研究,纳入209例粒细胞缺乏合并G+菌感染的患者,其中可评价疗效者189例,血液系统恶性肿瘤占72.6%(135/186);最常见的感染为导管相关血流感染(42.5%,79/186)和非导管相关血流感染(36.0%,67/186)[19];常见的病原菌为耐万古霉素粪肠球菌、MRSA和MSCNS;给予达托霉素6 mg/kg,治疗有效率为85.5%(159/186),药物不良事件12例(6.5%,12/186)。本研究的临床有效率为77.8%,略低于文献报道[6, 14-15, 17-18],可能与基础疾病不同和样本量小有关。
本研究中对血液病患者SSTI病原体的考虑,经验性的将G+菌感染放在首位,故首选抗G+菌的糖肽类和(或)
达托霉素安全性良好,不良反应发生率低,最常见的不良反应包括便秘、注射点的局部反应、恶心、头痛、腹泻和呕吐,导致被迫停药的主要原因为CK升高。国外一项针对高龄患者SSTI的研究,大部分患者有临床并发症且合并使用多种药物,与年轻患者应用同样剂量的达托霉素,并未出现特别的安全问题,因此,因达托霉素不良反应而停药的比例也很低[21]。本研究中未发生达托霉素不良反应,具有较好的安全性。
本研究结果显示,使用达托霉素治疗严重血液病SSTI表现出良好的抗菌效果,且起效迅速,不良反应少。但因本研究为回顾性研究,且病例数较少,尚需进一步积累临床经验,探索达托霉素最佳疗程。
| [1] |
邓琦, 李青, 林雪梅, 等. 2005—2011年血液系统疾病院内感染流行病学及耐药性变迁[J]. 中华血液学杂志, 2012, 33(12): 994-999. DOI:10.3760/cma.j.issn.0253-2727.2012.12.003 |
| [2] |
曹文彬, 苏东, 陈玉梅, 等. 血液病患者革兰阳性菌血流感染临床特征及耐药分析[J]. 中华血液学杂志, 2012, 33(7): 566-569. DOI:10.3760/cma.j.issn.0253-2727.2012.07.021 |
| [3] |
中国医师协会皮肤科分会. 皮肤及软组织感染诊断和治疗共识[J]. 临床皮肤科杂志, 2009, 38(12): 810-812. DOI:10.3969/j.issn.1000-4963.2009.12.036 |
| [4] |
《抗菌药物临床试验技术指导原则》写作组. 抗菌药物临床试验技术指导原则[J]. 中国临床药理学杂志, 2014, 30(9): 844-856. |
| [5] |
Wang SZ, Hu JT, Zhang C, et al. The safety and efficacy of daptomycin versus other antibiotics for skin and soft-tissue infections: a meta-analysis of randomised controlled trials[J]. BMJ Open, 2014, 4(6): e004744. DOI:10.1136/bmjopen-2013-004744 |
| [6] |
Aikawa N, Kusachi S, Mikamo H, et al. Efficacy and safety of intravenous daptomycin in Japanese patients with skin and soft tissue infections[J]. J Infect Chemother, 2013, 19(3): 447-455. DOI:10.1007/s10156-012-0501-9 |
| [7] |
Mascio CT, Alder JD, Silverman JA. Bactericidal action of daptomycin against stationary-phase and nondividing Staphylococcus aureus cells[J]. Antimicrob Agents Chemother, 2007, 51(12): 4255-4260. DOI:10.1128/AAC.00824-07 |
| [8] |
Safdar N, Andes D, Craig WA. In vivo pharmacodynamic activity of daptomycin[J]. Antimicrob Agents Chemother, 2004, 48(1): 63-68. DOI:10.1128/AAC.48.1.63-68.2004 |
| [9] |
Chaftari AM, Hachem R, Mulanovich V, et al. Efficacy and safety of daptomycin in the treatment of gram-positive catheter-related bloodstream infections in cancer patients[J]. Int J Antimicrob Agents, 2010, 36(2): 182-186. DOI:10.1016/j.ijantimicag.2010.03.015 |
| [10] |
中华医学会血液学分会, 中国医师协会血液科医师分会. 中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2016年版)[J]. 中华血液学杂志, 2016, 37(5): 353-359. |
| [11] |
Leonard SN, Rybak MJ. Evaluation of vancomycin and daptomycin against methicillin-resistant Staphylococcus aureus and heterogeneously vancomycin-intermediate S. aureus in an in vitro pharmacokinetic/pharmacodynamic model with simulated endocardial vegetations[J]. J Antimicrob Chemother, 2010, 63(1): 155-160. |
| [12] |
Kale-Pradhan P, Nguyen P, Johnson LB, et al. Effectiveness of daptomycin in patients with persistent methicillin-resistant Staphylococcus aureus bacteremia despite vancomycin[J]. Open Forum Infect Dis, 2017, 4(Suppl 1): S284. |
| [13] |
Potashman MH, Formella DN, Hamed K, et al. Comment on: Efficacy and safety of daptomycin for the treatment of infectious disease: a meta-analysis based on randomized controlled trials[J]. J Antimicrob Chemother, 2015, 70(4): 1274-1275. |
| [14] |
Gonzalez-Ruiz A, Gargalianos-Kakolyris P, Timerman A, et al. Daptomycin in the clinical setting: 8-year experience with gram-positive bacterial infections from the EU-CORE(SM) Registry[J]. Adv Ther, 2015, 32(6): 496-509. DOI:10.1007/s12325-015-0220-6 |
| [15] |
Seaton RA, Gonzalez-Ruiz A, Cleveland KO, et al. Real-world daptomycin use across wide geographical regions: results from a pooled analysis of CORE and EU-CORE[J]. Ann Clin Microbiol Antimicrob, 2016, 15: 18. DOI:10.1186/s12941-016-0130-8 |
| [16] |
张黎, 李军民, 万献尧, 等. 中国人群使用达托霉素治疗革兰阳性菌感染的有效性与安全性[J]. 中华内科杂志, 2015, 54(6): 496-500. |
| [17] |
Seaton RA, Gonzalez-Ramallo VJ, Prisco V, et al. Daptomycin for outpatient parenteral antibiotic therapy: a European registry experience[J]. Int J Antimicrob Agents, 2013, 41(5): 468-472. DOI:10.1016/j.ijantimicag.2013.01.019 |
| [18] |
Timerman A, Brites C, Bicudo E, et al. Brazilian experience in EU-CORE: daptomycin registry and treatment of serious gram-positive infections[J]. Braz J Infect Dis, 2013, 17(6): 647-653. DOI:10.1016/j.bjid.2013.03.005 |
| [19] |
Rolston KV, Besece D, Lamp KC, et al. Daptomycin use in neutropenic patients with documented gram-positive infections[J]. Support Care Cancer, 2014, 22(1): 7-14. DOI:10.1007/s00520-013-1947-8 |
| [20] |
Keil F, Daikos GL, Skoutelis A, et al. Daptomycin for gram-positive infections in patients with neutropenia: clinical experience from a european outcomes registry[J]. Adv Ther, 2015, 32(8): 715-726. DOI:10.1007/s12325-015-0231-3 |
| [21] |
Konychev A, Heep M, Moritz RK, et al. Safety and efficacy of daptomycin as first-line treatment for complicated skin and soft tissue infections in elderly patients: an open-label, multicentre, randomized phase IIIb trial[J]. Drugs Aging, 2013, 30(10): 829-836. DOI:10.1007/s40266-013-0114-8 |



