2. 山东省青岛市立医院呼吸与危重症医学科, 山东 青岛 266011;
3. 首都医科大学附属北京朝阳医院中毒与职业病医学科, 北京 100043;
4. 昆明医学院附属延安医院呼吸与危重症医学科, 云南 昆明 650051
2. Department of Respiratory and Critical Care Medicine, Qingdao Municipal Hospital, Qingdao 266011, China;
3. Department of Occupational Medicine and Toxicology, Beijing Chao-Yang Hospital, Capital Medical University, Beijing 100043, China;
4. Department of Respiratory and Critical Care Medicine, Yan'an Hospital Affiliated to Kunming Medical University, Kunming 650051, China
哮喘(asthma)是一种常见的慢性气道炎症性疾病,在全世界约影响3.4亿人[1]。据报道,哮喘在欧洲的发病率2%~10%不等[2-4]。在发展中国家,伴随城市化进程而来的空气污染、运动减少和压力增加等,哮喘的发病率呈上升趋势。相比于其他慢性气道疾病(如慢性阻塞性肺疾病),哮喘的病死率并不高[5-6]。但是由于哮喘可累及各年龄段的人群,特别是45岁以下的青壮年,导致劳动力下降甚至丧失,给社会带来沉重的经济负担[7-8]。社区获得性肺炎(community-acquired pneumonia, CAP)是常见的感染性疾病,在欧洲年发病率约为1.6/1 000~9/1 000[9-10]。近年来,CAP的病死率仍很高,是全球导致死亡的第四位原因,在感染性疾病中则是引起死亡的首要原因[11-12]。由于气道慢性炎症的存在,抗感染药物和糖皮质激素的反复使用等,合并哮喘的CAP(AS-CAP)患者可能具有不同的临床特征和结局。另外,哮喘患者发生CAP后,病原学有何不同,抗感染药物如何选择以及吸入糖皮质激素是否仍然可以继续使用等,一系列问题均困扰着临床医生,但此方面的研究少有报道,为探究上述问题,笔者对此展开了多中心、回顾性研究。
1 对象与方法 1.1 研究对象本研究为多中心、回顾性研究。研究单位包括北京积水潭医院、北京朝阳医院、青岛市立医院和昆明延安医院。检索上述四所医院2013年1月1日—2015年12月31日出院诊断包含“肺炎”或“肺部感染”的病例,按照入选标准筛选出影像学确诊的社区获得性肺炎病例。收集患者年龄、性别、基础疾病、入院24 h内PSI/CURB-65评分、血常规和生化检查(若有多次检查,取最差值)、影像学资料、病原学诊断、治疗情况和临床结局。入选标准[13]:(1)新近出现的咳嗽、咳痰或原有呼吸道疾病症状加重,伴或不伴胸痛;(2)发热或低体温;(3)肺实变体征和(或)闻及湿性啰音;(4)外周血白细胞>10×109/L或<4×109/L,伴或不伴细胞核左移;(5)胸部X线检查显示片状、斑片状浸润性阴影或间质性改变,伴或不伴胸腔积液。以上1~4项中任何1项加第5项。排除标准:(1)入院48 h后发生的肺炎;(2)非感染因素导致的类似肺炎临床症状体征或影像学改变,如肺水肿、肺不张、肺结核、肺间质病、肺血管炎、肺癌等;(3)年龄<14周岁;(4)免疫抑制患者;(5)合并慢性阻塞性肺疾病或慢性支气管炎的患者。
1.2 病原学诊断标准[14](1) 合格痰或气管吸引物,半定量培养≥++,定量培养≥105 CFU/mL(合格痰:鳞状上皮细胞<10个/低倍视野,多核白细胞>25个/低倍视野,或二者比例<1:2.5)。(2)肺泡灌洗液:半定量培养+~++或定量培养≥104 CFU/mL;保护性支气管镜刷检标本, 半定量培养+~++或定量培养≥103 CFU/mL;(3)血、胸腔积液或无菌肺组织等培养阳性(凝固酶阴性葡萄球菌除外);(4)尿肺炎链球菌和军团菌尿抗原阳性可作为肺炎链球菌肺炎和军团菌肺炎诊断依据;(5)血清呼吸道病毒IgG滴度呈四倍以上增高或(鼻)咽拭子、气管吸取物或肺泡灌洗液用RT-PCR方法检测病毒核酸阳性者诊断为相应病毒性肺炎;(6)血清肺炎支原体或肺炎衣原体IgM阳性或IgG滴度呈四倍以上增高,或(鼻)咽拭子、气管吸取物或肺泡灌洗液用RT-PCR方法检测肺炎支原体/肺炎衣原体核酸阳性者诊断为支原体/衣原体肺炎。
1.3 相关定义[15](1) 哮喘:定义为随时间和强度变化的呼吸道症状,如喘息或咳嗽,曾经肺功能检查证实存在可逆性呼气气流受限;(2)慢性阻塞性肺疾病:定义为有慢性咳嗽/咳痰或伴呼吸困难的病史,使用支气管扩张剂后FEV1/FVC < 70%;(3)心血管病:包括冠心病、心肌病、充血性心衰;(4)脑血管病:包括短暂性脑缺血发作、脑梗死、脑出血、蛛网膜下腔出血等;(5)糖尿病:包括1型糖尿病、2型糖尿病、妊娠期糖尿病和特殊类型糖尿病,但不包括糖耐量异常和空腹血糖受损此两类糖尿病前期状态;(6)慢性肾病:包括糖尿病肾病、高血压肾损伤、慢性肾小球肾炎、慢性肾盂肾炎、狼疮性肾炎、IgA肾病、肾病综合征、遗传性肾病等;(7)慢性肝病:包括慢性病毒性肝炎、酒精性肝炎、遗传性肝病、肝硬化等;(8)长期吸烟史:定义为在过去一年吸烟超过10支/天;(9)酗酒史:定义为2周内一次喝≥5瓶啤酒(500 mL/瓶)或半斤以上白酒;或饮酒超过5年,平均每天喝≥2.5瓶啤酒(500 mL/瓶)或2两以上白酒;(10)吸入因素:包括呛咳、溺水、鼻饲、假性球麻痹、痴呆、昏迷、中毒、帕金森病、胃食管反流;(11)吸入糖皮质激素使用史:定义为发病前30 d曾连续使用吸入糖皮质激素,剂量不限;(12)免疫抑制状态:包括人类免疫缺陷病毒(HIV)阳性,先天性免疫缺陷(如先天性巨球蛋白血症、先天性IgA缺乏等),免疫抑制治疗[16];(13)免疫抑制剂治疗:包括放射治疗、细胞毒药物治疗、抗排斥治疗和使用系统性糖皮质激素[16];(14)脓毒休克:定义为尽管给予积极地液体复苏,仍然需要使用血管活性药物超过4 h;(15)呼吸衰竭:定义为平静呼吸室内空气时,PO2<60 mmHg或伴PCO2≥50 mmHg;(16)心功能衰竭:定义为心脏扩大,射血分数<40%;(17)急性肾衰:定义为尿量<20 mL/h或80 mL/4 h;(18)肝损伤:定义为血清转氨酶超过正常上限5倍或胆红素超过正常上限2倍。
1.4 统计学方法应用SPSS19.0软件进行统计分析,计量数据先进行正态性检验(Kolmogorov-Sm irnov检验),呈正态分布的计量资料以均数±标准差(x±s)表示,采用t检验进行比较。非正态分布的计量资料以中位数、四分位间距(IQR)表示,应用Mann-Whitney检验。计数资料以例数表示,采用卡方检验或Fisher确切概率法进行比较。AS-CAP患者根据其30天是否死亡分为生存组和死亡组。单因素分析法比较两组差异,双侧P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况共3 901例CAP患者纳入分析,男性占53.2%(2 075/3 901),年龄中位数为66.0岁(IQR:53.0~78.0岁)。其中AS-CAP占5.9%(231例)。
2.2 两组患者人口学特征及病情严重程度比较相比于非AS-CAP组,AS-CAP组患者年龄较轻,多为女性,吸入因素、1年内CAP病史和吸入糖皮质激素使用史比例高,差异均有统计学意义;基础病、病情严重性程度比较,差异均无统计学意义。见表 1。
| 表 1 AS-CAP和非AS-CAP患者人口学特征及病情严重程度比较[例(%)] Table 1 Comparison in demographic characteristics and disease severity between AS-CAP and non-AS-CAP patients(No. of cases [%]) |
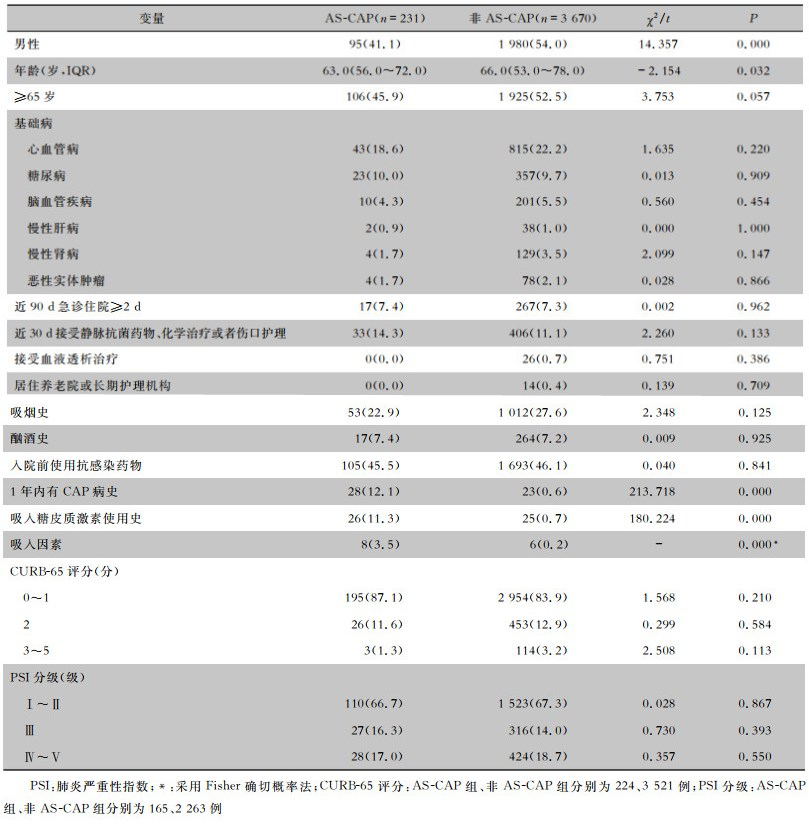
|
与非AS-CAP组比较,AS-CAP组患者发生胸腔积液比例低。其他临床症状体征和实验室检查方面,两组患者差异无统计学意义。见表 2。
| 表 2 AS-CAP和非AS-CAP患者临床及影像学特征比较[例(%)] Table 2 Comparison in clinical and imaging characteristics between AS-CAP and non-AS-CAP patients(No. of cases [%]) |
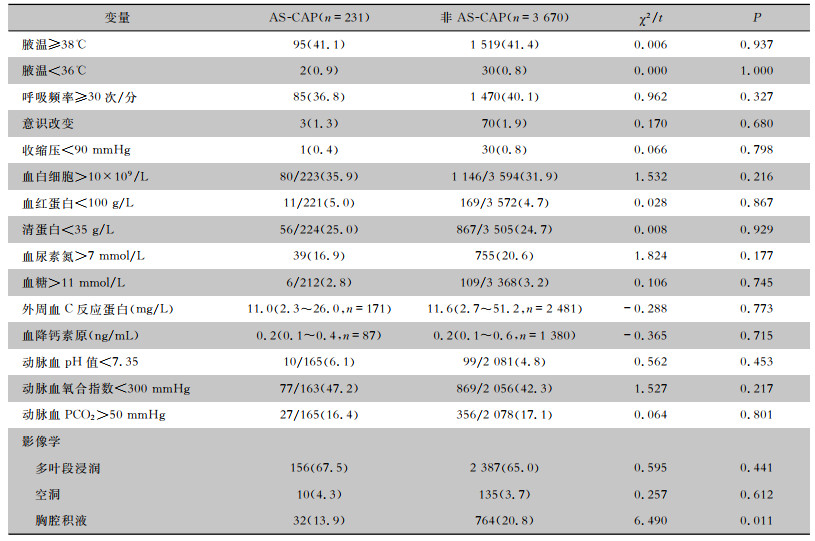
|
6.9%(16/231)的AS-CAP和8.3%(306/3 670)的非AS-CAP患者获得病原学诊断。两组患者分离病原菌均以肺炎链球菌为最常见。见表 3。
| 表 3 AS-CAP和非AS-CAP患者病原体分布情况(株) Table 3 Pathogenic distribution of AS-CAP and non-AS-CAP patients (No. of isolates) |
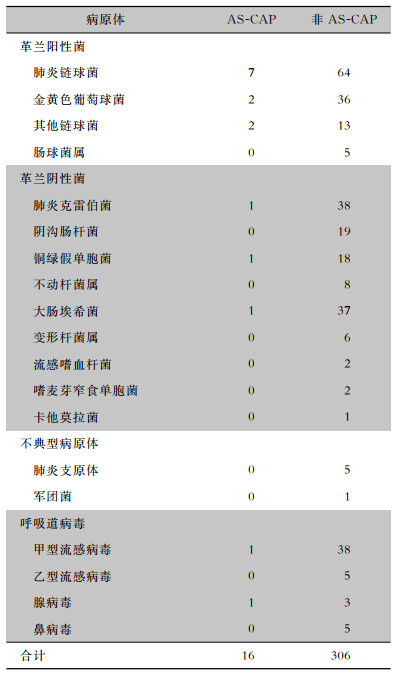
|
AS-CAP组与非AS-CAP组患者在机械通气、并发症、入住ICU以及30天病死率方面比较,差异无统计学意义。见表 4。
| 表 4 AS-CAP和非AS-CAP患者临床结局的比较[例(%)] Table 4 Comparison in clinical outcomes between AS-CAP and non-AS-CAP patients(No. of cases [%]) |
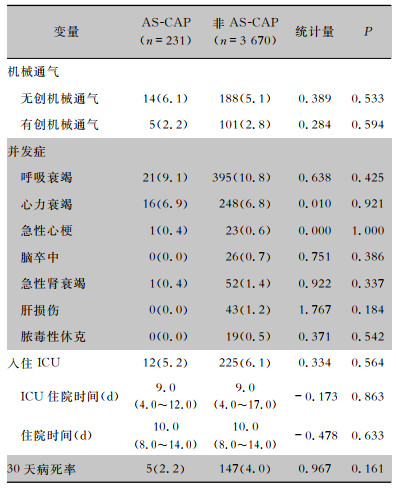
|
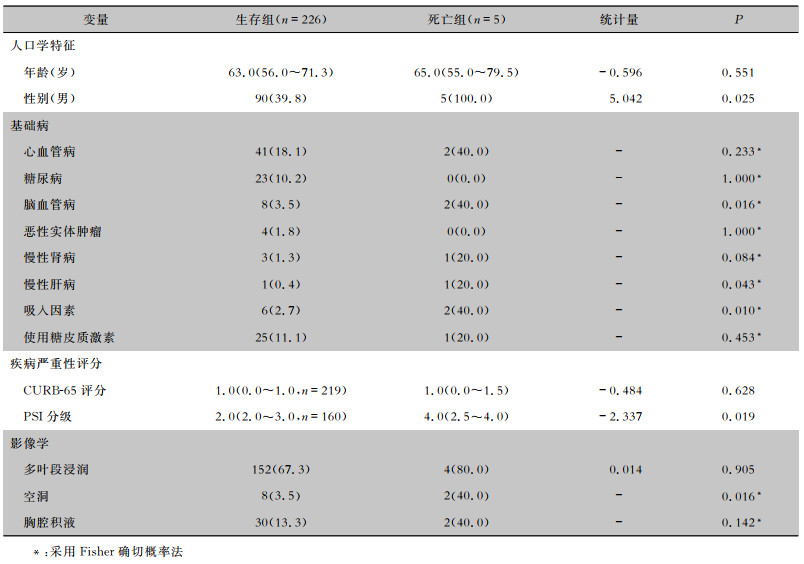
与生存组相比,死亡组男性、脑血管病、慢性肝病、吸入因素和影像学空洞比例更高,PSI分级更高,差异均有统计学意义,见表 5。年龄、其他基础病和临床及影像学特征方面比较,两组差异均无统计学意义。
| 表 5 AS-CAP患者30天死亡危险因素的单因素分析 Table 5 Univariate analysis on risk factors for 30-day mortality of AS-CAP patients |
|
本研究为目前国内最大规模的关于哮喘对社区获得性肺炎疾病特征和结局影响的多中心、回顾性研究,涉及人口学、病情严重性、临床和影像学特征、病原学分布以及临床结局各个方面。研究人群既包括青壮年,也包括14岁以上的青少年和老年人群,包括普通病房和ICU的患者。研究发现,AS-CAP、非AS-CAP临床特征和结局基本相似,合并哮喘不增加CAP的病情严重性和病死率;除PSI分级之外,吸入因素可能也是AS-CAP患者30天病死率的危险因素,有助于临床医生对预后进行早期评估。
研究显示,AS-CAP患者多为女性,总体年龄较轻,既往多有ICs使用史,一年内有反复发生CAP病史。多项研究[17-20]证实, 哮喘患者发生CAP的风险增高。一项针对65岁以上老年人群为期三年的前瞻性研究发现,合并支气管哮喘能增加该人群发生肺炎的风险(RR= 4.2, 95%CI=3.3-5.4)[19]。基于大样本人群的病例对照研究[18]显示,哮喘本身是独立于吸入糖皮质激素之外增加CAP发生风险的独立危险因素(OR=2.33, P=0.001)。哮喘患者气道黏膜上皮细胞和黏膜下组织胶原沉积,杯状细胞增生,气道黏液分泌增加,黏液构成改变导致黏液黏稠以及纤毛运动障碍,均使气道清除功能下降,气道阻塞;加上慢性炎症的影响,局部免疫功能受损,导致对病原体的易感性增加,肺炎发生率增高。长期使用ICs能增加肺炎发生的风险,这一点在慢性阻塞性肺疾病患者中已经得到较充分的研究[21-22],但在哮喘方面还存在争议。Almirall等[23]发现,哮喘患者肺炎发生风险增高与抗胆碱能吸入药物相关,但与使用糖皮质激素无关。Qian等[24]大样本回顾性研究显示,不管是吸入布地奈德还是氟替卡松,都增加哮喘患者发生肺炎的风险,且这种风险随着吸入剂量的增加而增高。O’Byrne等[25]研究也支持吸入糖皮质激素增加哮喘患者肺炎发生的风险。本组研究提示在哮喘-吸入糖皮质激素-发生肺炎之间的确存在某种联系,但具体机制还有待进一步阐明。
研究结果显示,AS-CAP患者和非AS-CAP患者的临床症状相似。发热、血白细胞、C反应蛋白、降钙素原水平以及影像学多叶段浸润情况两组比较,差异无统计学意义,提示虽然哮喘患者存在持续的气道炎症,但是发生CAP后体内炎症反应的程度较非哮喘患者并无明显增高。体现病情严重性的PSI分级/CURB-65评分,以及主要临床结局(机械通气、入住ICU和30天病死率等)两组情况也非常接近。本组AS-CAP发生胸腔积液的比例低于非AS-CAP者。既往[26-27]研究表明,使用糖皮质激素能降低肺炎患者发生胸腔积液的概率。实验表明,糖皮质激素能抑制气道核因子κB(NF-κB)的表达,进而抑制白细胞介素-1、白细胞介素-6、白细胞介素-8等一系列细胞因子的产生。而上述细胞因子在趋化中性粒细胞进入胸膜腔和炎症渗出产生胸腔积液过程中具有关键作用[28]。AS-CAP组有11.3%的患者长期使用糖皮质激素,或许能部分解释为何该组人群胸腔积液发生率较低。在本研究中,AS-CAP患者30天病死率为2.2%,与研究[29-32]报道1%~4%的病死率一致。研究[26, 29, 32]显示,相比于非AS-CAP,合并哮喘的CAP患者病死率并无明显增高,甚至更低。本研究结果也支持上述结论,合并哮喘不显著增加CAP患者30天病死率。机制尚不清楚,使用ICs可能并不影响病死率[29-31]。
本研究结果显示,仅6.9%的AS-CAP患者和8.3%的非AS-CAP患者获得病原学诊断,肺炎链球菌是最主要的致病菌,与Terraneo等[32]研究结果一致,合并哮喘的CAP患者病原学谱和无哮喘的CAP患者无异。因此认为,哮喘患者发生CAP后,仍然可以遵循目前中国CAP指南选择经验性抗感染药物。研究[17, 20, 33-34]证实,哮喘患者对肺炎链球菌易感性增高,更容易发生侵袭性肺炎链球菌感染。可能的机制包括:(1)慢性炎症导致气道重塑,伴随气道纤毛运动障碍、黏液分泌过多和气道阻塞导致对病原体的清除功能下降。气道的结构异常还导致对病毒的易感性增加,为肺炎链球菌感染创造条件。(2)糖皮质激素的使用可增加哮喘患者气道内肺炎链球菌定植,局部免疫功能抑制也可引起侵袭性感染。(3)哮喘患者固有免疫和适应性免疫功能的削弱,也在侵袭性肺炎链球菌感染中发挥作用。
本组研究结果显示,除了PSI分级,吸入因素也是与AS-CAP患者30天病死率相关的危险因素。研究[35-37]表明,通过精细的检查,如胃镜、食道pH值监测、吞咽功能检查等,哮喘患者可能存在普遍的胃食管反流和吸入现象。本研究中具有明确吸入因素的哮喘患者仅占3.5%,主要是因为对导致可能引起吸入的相关疾病诊断不足。尽管如此,吸入比例仍高于非AS-CAP组。吸入性肺炎病原体常为厌氧菌、耐甲氧西林金黄色葡萄球菌、革兰阴性杆菌等,耐药程度高[38-39],初始抗感染方案常覆盖不全,导致合理的经验性治疗延迟,病死率升高。另外,吸入肺炎患者通常年龄更大,基础病多,肺炎严重性指数更高。Lanspa等[40]多中心研究纳入了5 185例CAP,其中415例为吸入肺炎,吸入肺炎患者ICU住院率和住院期间病死率均高于非吸入肺炎患者。
本研究也具有一些缺陷:(1)尽管样本量大,但是回顾性研究,具有回顾性研究的天然缺陷。如有些患者出院诊断可能仅写“肺部病变”或“肺部阴影”,采用本研究的检索方法可能会遗漏少量CAP病例,增加选择性偏倚。(2)实际临床管理中,由于临床医生病原学诊断意识淡薄、技术手段受限,病原学诊断率低,本研究获得的病原学不能完全代表真实的CAP病原学分布。(3)本研究人群均为住院患者,所得结论不能直接推广到门急诊患者。(4)由于缺少肺功能资料,无法根据患者的肺功能进行分层分析。研究[41]显示,重度哮喘和轻中度哮喘患者合并下呼吸道感染时可能具有不同的病原学分布。(5)本研究排除了免疫缺陷患者以及合并慢性阻塞性肺疾病的患者,故结论不适用于长期口服糖皮质激素的哮喘患者和重叠综合征的患者。
总之,本组研究结果为临床医生认识AS-CAP的临床特征和评估预后提供了基础数据,但还需进一步开展大样本、前瞻性研究加以证实。
| [1] |
Croisant S. Epidemiology of asthma:prevalence and burden of disease[J]. Adv Exp Med Biol, 2014, 795: 17-29. |
| [2] |
To T, Stanojevic S, Moores G, et al. Global asthma prevalence in adults:findings from the crosssectional world health survey[J]. BMC Public Health, 2012, 12: 204. DOI:10.1186/1471-2458-12-204 |
| [3] |
Bateman ED, Hurd SS, Barnes PJ, et al. Global strategy for asthma management and prevention:GINA executive summary[J]. Eur Respir J, 2008, 31(1): 143-178. DOI:10.1183/09031936.00138707 |
| [4] |
Ding B, Small M. Disease burden of mild asthma:findings from a cross-sectional real-world survey[J]. Adv Ther, 2017, 34(5): 1109-1127. DOI:10.1007/s12325-017-0520-0 |
| [5] |
Beran D, Zar HJ, Perrin C, et al. Burden of asthma and chronic obstructive pulmonary disease and access to essential medicines in low-income and middle-income countries[J]. Lancet Respir Med, 2015, 3(2): 159-170. DOI:10.1016/S2213-2600(15)00004-1 |
| [6] |
Burney P, Jarvis D, Perez-Padilla R. The global burden of chronic respiratory disease in adults[J]. Int J Tuberc Lung Dis, 2015, 19(1): 10-20. DOI:10.5588/ijtld.14.0446 |
| [7] |
Akinbami LJ, Moorman JE, Liu X. Asthma prevalence, health care use, and mortality:United States, 2005-2009[J]. Natl Health Stat Report, 2011(32): 1-14. |
| [8] |
Sullivan PW, Slejko JF, Ghushchyan VH, et al. The relationship between asthma, asthma control and economic outcomes in the United States[J]. J Asthma, 2014, 51(7): 769-778. DOI:10.3109/02770903.2014.906607 |
| [9] |
Almirall J, Bolíbar I, Vidal J, et al. Epidemiology of community-acquired pneumonia in adults:a population-based study[J]. Eur Respir J, 2000, 15(4): 757-763. DOI:10.1034/j.1399-3003.2000.15d21.x |
| [10] |
Jokinen C, Heiskanen L, Juvonen H, et al. Incidence of community-acquired pneumonia in the population of four municipalities in eastern Finland[J]. Am J Epidemiol, 1993, 137(9): 977-988. DOI:10.1093/oxfordjournals.aje.a116770 |
| [11] |
File TM Jr, Marrie TJ. Burden of community-acquired pneumonia in North American adults[J]. Postgrad Med, 2010, 122(2): 130-141. DOI:10.3810/pgm.2010.03.2130 |
| [12] |
Miniño AM, Heron MP, Smith BL. Deaths:preliminary data for 2004[J]. Natl Vital Stat Rep, 2006, 54(19): 1-49. |
| [13] |
中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 |
| [14] |
Jiang W, Wu M, Zhou J, et al. Etiologic spectrum and occurrence of coinfections in children hospitalized with community-acquired pneumonia[J]. BMC Infect Dis, 2017, 7(1): 787. |
| [15] |
Chen L, Zhou F, Li H, et al. Disease characteristics and management of hospitalised adolescents and adults with community-acquired pneumonia in China:a retrospective multicentre survey[J]. BMJ Open, 2018, 8(2). |
| [16] |
Healthcare Infection Control Practices Advisory Committee; Centers for Disease Control and Prevention (U.S.). Guidelines for preventing health-care-associated pneumonia, 2003 recommendations of the CDC and the Healthcare Infection Control Practices Advisory Committee[J]. Respir Care, 2004, 49(8): 926-939. |
| [17] |
Talbot TR, Hartert TV, Mitchel E, et al. Asthma as a risk factor for invasive pneumococcal disease[J]. N Engl J Med, 2005, 352(20): 2082-2090. DOI:10.1056/NEJMoa044113 |
| [18] |
Almirall J, Bolíbar I, Serra-Prat M, et al. New evidence of risk factors for community-acquired pneumonia:a population-based study[J]. Eur Respir J, 2008, 31(6): 1274-1284. DOI:10.1183/09031936.00095807 |
| [19] |
Koivula I, Sten M, Mäkelä PH. Risk factors for pneumonia in the elderly[J]. Am J Med, 1994, 96(4): 313-320. DOI:10.1016/0002-9343(94)90060-4 |
| [20] |
Juhn YJ, Kita H, Yawn BP, et al. Increased risk of serious pneumococcal disease in patients with asthma[J]. J Allergy Clin Immunol, 2008, 122(4): 719-723. |
| [21] |
Contoli M, Corsico AG, Santus P, et al. use of ICS in COPD:from blockbuster medicine to precision medicine[J]. COPD, 2017, 14(6): 641-647. DOI:10.1080/15412555.2017.1385056 |
| [22] |
Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia[J]. Thorax, 2013, 68(11): 1029-1036. DOI:10.1136/thoraxjnl-2012-202872 |
| [23] |
Almirall J, Serra-Prat M, Bolíbar I, et al. Risk factors for community-acquired pneumonia in adults:a systematic review of observational studies[J]. Respiration, 2017, 94(3): 299-311. DOI:10.1159/000479089 |
| [24] |
Qian CJ, Coulombe J, Suissa S, et al. Pneumonia risk in asthma patients using inhaled corticosteroids:a quasi-cohort study[J]. Br J Clin Pharmacol, 2017, 83(9): 2077-2086. DOI:10.1111/bcp.13295 |
| [25] |
O'Byrne PM, Pedersen S, Carlsson LG, et al. Risks of pneumonia in patients with asthma taking inhaled corticosteroids[J]. Am J Respir Crit Care Med, 2011, 183(5): 589-595. DOI:10.1164/rccm.201005-0694OC |
| [26] |
Liapikou A, Polverino E, Ewig S, et al. Severity and outcomes of hospitalised community-acquired pneumonia in COPD patients[J]. Eur Respir J, 2012, 39(4): 855-861. DOI:10.1183/09031936.00067111 |
| [27] |
Sellares J, López-Giraldo A, Lucena C, et al. Influence of previous use of inhaled corticoids on the development of pleural effusion in community-acquired pneumonia[J]. Am J Respir Crit Care Med, 2013, 187(11): 1241-1248. DOI:10.1164/rccm.201209-1732OC |
| [28] |
Singanayagam A, Chalmers JD, Hill AT. Inhaled corticosteroids and risk of pneumonia:evidence for and against the proposed association[J]. QJM, 2010, 103(6): 379-385. DOI:10.1093/qjmed/hcq023 |
| [29] |
To M, To Y, Yamada H, et al. Influence of inhaled corticosteroids on community-acquired pneumonia in patients with bronchial asthma[J]. Intern Med, 2004, 43(8): 674-678. DOI:10.2169/internalmedicine.43.674 |
| [30] |
Almirall J, Bolíbar I, Serra-Prat M, et al. Relationship between the use of inhaled steroids for chronic respiratory diseases and early outcomes in community-acquired pneumonia[J]. PLoS One, 2013, 8(9). |
| [31] |
Ferrer M, Torres A, Martínez R, et al. Inhaled corticosteroids and systemic inflammatory response in community-acquired pneumonia:a prospective clinical study[J]. Respirology, 2014, 19(6): 929-935. DOI:10.1111/resp.12324 |
| [32] |
Terraneo S, Polverino E, Cilloniz C, et al. Severity and outcomes of community acquired pneumonia in asthmatic patients[J]. Respir Med, 2014, 108(11): 1713-1722. DOI:10.1016/j.rmed.2014.09.001 |
| [33] |
Kwak BO, Choung JT, Park YM. The association between asthma and invasive pneumococcal disease:a nationwide study in Korea[J]. J Korean Med Sci, 2015, 30(1): 60-65. DOI:10.3346/jkms.2015.30.1.60 |
| [34] |
Klemets P, Lyytikäinen O, Ruutu P, et al. Risk of invasive pneumococcal infections among working age adults with asthma[J]. Thorax, 2010, 65(8): 698-702. DOI:10.1136/thx.2009.132670 |
| [35] |
Ozcan M, Ortapamuk H, Naldoken S, et al. Pulmonary aspiration of nasal secretions in patients with chronic sinusitis and asthma[J]. Arch Otolaryngol Head Neck Surg, 2003, 129(9): 1006-1009. DOI:10.1001/archotol.129.9.1006 |
| [36] |
De Vooght V, Vanoirbeek JA, Haenen S, et al. Oropharyngeal aspiration:an alternative route for challenging in a mouse model of chemical-induced asthma[J]. Toxicology, 2009, 259(1-2): 84-89. DOI:10.1016/j.tox.2009.02.007 |
| [37] |
Houghton LA, Lee AS, Badri H, et al. Respiratory disease and the oesophagus:reflux, reflexes and microaspiration[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(8): 445-460. DOI:10.1038/nrgastro.2016.91 |
| [38] |
DiBardino DM, Wunderink RG. Aspiration pneumonia:a review of modern trends[J]. J Crit Care, 2015, 30(1): 40-48. DOI:10.1016/j.jcrc.2014.07.011 |
| [39] |
Marik PE. Aspiration pneumonitis and aspiration pneumonia[J]. N Engl J Med, 2001, 344(9): 665-671. DOI:10.1056/NEJM200103013440908 |
| [40] |
Lanspa MJ, Peyrani P, Wiemken T, et al. Characteristics associated with clinician diagnosis of aspiration pneumonia:a descriptive study of afflicted patients and their outcomes[J]. J Hosp Med, 2015, 10(2): 90-96. DOI:10.1002/jhm.2280 |
| [41] |
To M, To Y, Yamada H, et al. Clinical properties of community-acquired pneumonia in patients with asthma[J]. Nihon Kokyuki Gakkai Zasshi, 2003, 41(2): 89-94. |



