异基因造血干细胞移植(allergenic hematopoietic stem cell transplantation, Allo-HSCT)是治疗血液系统疾病、某些实体肿瘤以及遗传代谢性疾病的重要手段。造血干细胞移植(HSCT)前需接受大剂量放射治疗及化学治疗,导致骨髓抑制,干细胞植入后防治移植物抗宿主病(graft versus host disease, GVHD)的免疫抑制剂的使用,以及移植后早期免疫功能并未重建均可导致免疫低下/缺陷,故而细菌、病毒、真菌等感染率增高,而肺部感染依然是HSCT后最主要的感染相关死亡原因。隐球菌是自然界广泛存在的一类真菌,属于机会致病菌,主要感染免疫力低下患者,尤其是实体器官移植(solid organ transplantation, SOT),和/或HSCT术后患者。据文献[1]报道,隐球菌是仅次于假丝酵母菌、毛霉和曲霉菌属引发SOT患者术后感染的第三大侵袭性真菌,而肺隐球菌感染(cryptococcosis)是主要由新生肺隐球菌引起的亚急性或慢性肺部真菌病,由于器官移植、免疫抑制剂的使用,使其感染率上升。由于其临床表现不典型、病程长、疗效慢,无特异性的影像学表现,使其误诊率高,极易误诊为普通肺炎、肺结核或肺部肿瘤等。并且,肺隐球菌感染的痰培养和涂片阳性检出率较低,一般低于25%,故临床上易被忽视,但如果引起严重的并发症,病死率高达70%[2-3]。本文报道一例Allo-HSCT后并发肺部感染、胸腔积液,经多轮抗菌药物治疗无效,拟诊为隐球菌感染后,经验性给予氟康唑治疗,其病情好转痊愈出院,现报告如下。
1 病历资料 1.1 病史患者,男性,16岁,于2014年1月在陆军军医大学第二附属医院血液科诊断为“急性淋巴细胞白血病(T-ALL,高危)”。先后给予诱导、巩固化学治疗后达到完全缓解(CR),且在中华骨髓库找到HLA配型全相合的健康供者。完善肺部CT,心脏、腹部超声等辅助检查,结果无特殊。
1.2 治疗经过患者于2014年7月9日入层流仓,给予TBI+CY+ATG的方案预处理后回输供者外周血干细胞。同时予以环孢素、短程骁悉、MTX防治移植物抗宿主病(GVHD)。移植第8天出现发热,体温38.5℃,在诊断上考虑患者处于骨髓抑制期,粒细胞缺乏伴感染。经验性给予亚胺培南(0.5 g,q6h)、替考拉宁(400 mg,qd)、伊曲康唑(200 mg,qd)联合抗感染,体温控制不佳。
移植第15天,复查患者血象提示造血开始重建,血常规:白细胞计数(WBC)2.52×109/L,中性粒细胞计数(NEUT)2.14×109/L,血红蛋白(HGB)72 g/L,血小板计数(PLT)32×109/L。但患者仍反复发热,体温波动在38.5℃~39.4℃。诊断考虑感染的可能性大,继续使用抗生素联合抗真菌药物[头孢哌酮/舒巴坦钠(3 g,q8h)、替考拉宁、伏立康唑(3 mg/kg,q12h)],同时加用静脉滴注人免疫球蛋白抗病毒、提高抗体免疫力。至移植第19天,患者仍然高热,体温最高39.3℃。复查血常规:WBC 4.59×109/L,NEUT 3.81×109/L,HGB 71 g/L,PLT 40×109/L。行细菌培养、巨细胞病毒(CMV)、TORCH等指标检测均阴性,但超声提示多浆膜腔积液。在诊断上考虑感染引起的发热、浆膜腔积液。此时需警惕移植物抗宿主病(GVHD)引起发热的可能,但无皮疹、腹泻、肝功能损伤等其他GVHD的表现。治疗上调整抗生素组合为替加环素、头孢哌酮/舒巴坦钠、伏立康唑。移植第21天,患者出仓,复查肺部CT提示:左下肺感染,左侧胸腔积液伴被动性肺不张(见图 1A、B)。行胸腔穿刺抽液术,完善胸腔积液细菌、真菌、结核分枝杆菌等相关检查,结果均为阴性。移植第24天,患者仍然反复发热,将抗生素调整为莫西沙星(0.4 g,qd)、头孢他啶(1.0 g,q8h)、伏立康唑、阿昔洛韦。再次行胸腔穿刺抽液术,在胸腔积液中查见CMV DNA 161 IU/mL,虽然病毒滴度较低,仍加用膦甲酸钠抗CMV感染治疗。同时胸腔积液培养检出无色杆菌,根据药敏试验结果,将抗感染药物调整为莫西沙星、哌拉西林/他巴唑,同时继续给予伏立康唑、阿昔洛韦、膦甲酸钠(60 mg/kg,q8h)。此后患者仍然反复发热,最高体温39℃(见图 2),在移植第35天,将抗生素调整为头孢哌酮/舒巴坦钠、阿米卡星、伏立康唑继续抗感染治疗。
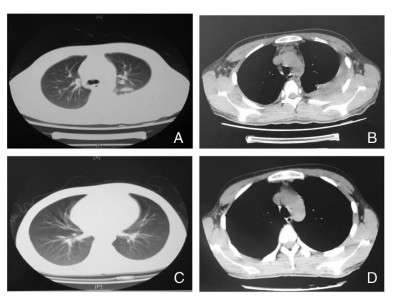 |
| A、B:氟康唑治疗前;C、D:氟康唑治疗后 图 1 Allo-HSCT术后患者肺部CT治疗前后比较 Figure 1 Pulmonary CT image of patient following Allo-HSCT before and after treatment |
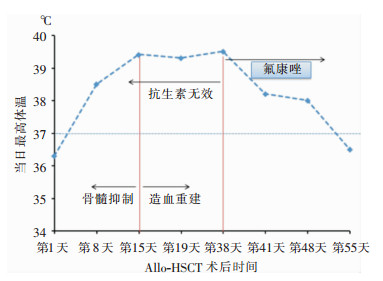 |
| 图 2 Allo-HSCT术后患者体温曲线 Figure 2 Temperature curve of patient after Allo-HSCT |
移植第38天,患者仍然反复发热,最高体温39.5℃,伴有咳嗽、咳痰,考虑不单是由于无色杆菌胸腔感染引起,再次行胸腔穿刺抽液,抽出血性胸腔积液。请呼吸科教授急会诊后分析:患者行Allo-HSCT造血重建后反复发热,CT提示左侧胸腔积液,双下肺可见小结节影(见图 1A、B)。结合胸腔积液为血性胸腔积液,多种抗细菌、抗真菌感染药物治疗疗效差,体温控制不佳。考虑诊断:移植后肺部感染,隐球菌等特殊病原体感染可能性大。但是,胸腔积液送检墨汁染色阴性。鉴于此,拟诊为隐球菌感染,治疗措施:停用伏立康唑,换用氟康唑注射液(0.6 g,qd),同时保留头孢哌酮/舒巴坦钠、阿米卡星继续抗细菌感染治疗。加用氟康唑3 d后(即移植第41天),患者体温高峰下降,最高38.2℃。移植第48天,体温最高38℃。移植第55天,再次复查CT提示:胸腔积液量以及左上肺结节影无明显改变,但患者体温正常,说明治疗有效。移植第62天,停用头孢哌酮/舒巴坦钠以及阿米卡星,改为口服磺胺甲
在HSCT后发生肺隐球菌感染,临床上相当少见,其临床主要表现为急性下呼吸道感染,可伴随高热、呼吸困难等症状,或伴有明显的低氧血症,严重者可发展为急性呼吸衰竭,如不及时诊治,病死率高。关于隐球菌的诊断,需要结合患者病史、呼吸系统症状和胸部CT表现等。但其肺部影像学无特征性改变,肺部CT表现多样,通常分为单发或多发结节影、片状浸润影和弥漫混合病变等三种类型,临床常需与肺部一般细菌感染、肺结核、肺癌等相鉴别[4]。其辅助检查主要依靠组织病理检查和病灶内脓液穿刺标本的病原学涂片和培养。另外,由于新生隐球菌可以定植于正常人群,故痰、支气管肺泡灌洗液培养阳性者仍需加以分析,排除定植[5-6]。本文报告的病例经相关检测并未得到明确的隐球菌病原学证据,但根据血液病/恶性肿瘤患者侵袭性真菌的诊断标准与治疗原则,本例只能拟诊为“侵袭性真菌病(IFD)”,对肺部多发结节状病灶、胸腔积液,在其正规抗感染治疗后仍无效,要考虑肺隐球菌感染的可能。本例以发热为起始点,不具备微生物学证据,经验治疗给予氟康唑的目的在于降低IFD病死率。
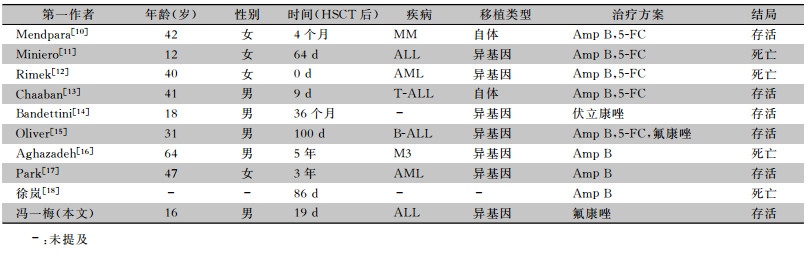
隐球菌感染,在器官移植受者是一种明确的机会性感染,其发病率低,但病死率高。查阅文献,血液系统肿瘤患者行HSCT后继发隐球菌感染的病例报道在10例左右,其治疗方法以及预后各自不一。Sun等[7]报道17 226例实体器官移植患者中隐球菌感染率占9%,而16 390例HSCT患者中仅有9例发生隐球菌感染,发生率为0.05%。隐球菌对中枢神经系统的亲和力最高,且临床可存在无症状中枢神经系统隐球菌感染[8]。肺隐球菌病合并脑膜炎者,脑脊液墨汁染色涂片中镜下可找到隐球菌[9]。Mendpara等[10]报道了一例多发性骨髓瘤(MM)患者在自体HSCT后4个月,发生隐球菌脑膜炎。Miniero等[11]报道了一例急性淋巴细胞白血病(ALL)患者在自体HSCT术后60余天发生隐球菌性脑膜炎而死亡。Rimek等[12]报道了一例急性髓系白血病(AML)患者在自体造血HSCT后发生隐球菌脑膜炎而死亡。Chaaban等[13]报道一例T细胞淋巴瘤患者自体HSCT后发生隐球菌脑炎,给予两性霉素B(Amp B)、氟胞嘧啶(5-FC)治疗后好转。Bandettini等[14]报道一例使用伏立康唑治疗隐球菌脑膜炎有效的患者。Oliver等[15]报道了一例B-ALL患者接受Allo-HSCT术后1年发生肾隐球菌感染、肾衰竭,经Amp B、氟康唑治疗后好转。Aghazadeh等[16]报道了一例64岁老年AML-M3男性患者,经HSCT 6个月后意识丧失,经检查为隐球菌感染引起的脑膜炎,经Amp B治疗后无效,因呼吸衰竭而死亡。Park等[17]报道了一例47岁AML女性患者,行HSCT后,再次复发,且发生皮肤播散性隐球菌感染,经Amp B治疗后好转。国内相关文献报道更少,徐岚等[18]曾报道过HSCT后因隐球菌脑膜炎死亡的案例。总之,隐球菌感染发生率低,一旦发生,其临床表现多样,以及实验室检出率低,易忽视而漏诊误诊,从而影响疗效。见表 1。
| 表 1 HSCT后发生隐球菌感染的病例报道 Table 1 Case reports about cryptococcal infection after HSCT |
|
关于隐球菌感染的治疗,根据艾滋病诊疗指南[19],推荐使用氟康唑治疗肺隐球菌感染。氟康唑为三唑类抗真菌药,吸收后在体内广泛分布,皮肤、水泡液、腹腔积液、痰液中药物浓度均可达血药浓度的1~2倍。另外也可选择Amp B和5-FC的联合应用。但是Amp B在体液如胸/腹腔积液、滑膜炎、支气管分泌物等中的药物浓度均较低,且毒性、不良反应大;而5-FC广泛分布在肝、肾、脾、心和肺组织中,也可进入感染的腹腔、关节腔和房水中,但易产生耐药[20]。本例患者考虑肺部隐球菌感染,直接给予氟康唑治疗,效果好。
3 讨论该例患者发热病程较长,大致可分为三个阶段,第一阶段是干细胞回输后,造血未重建之前,考虑骨髓抑制,粒细胞缺乏。第二个阶段造血开始重建,先后在胸腔积液中发现CMV、无色杆菌,同时胸腔积液培养也无隐球菌及结核分枝杆菌感染的证据,同时也无GVHD的依据,故考虑细菌或病毒感染的可能性大,局限了临床思维。文献[21]报道器官移植后,隐球菌感染的发病率低,仅0.2% ~ 4.1%,未考虑到临床上很少发生的隐球菌感染的可能。到第三阶段,由于抗细菌感染治疗无效,再结合CT影像学,改变思路,临床诊断为隐球菌感染,给予氟康唑治疗,患者体温迅速得到控制,胸腔积液吸收,病情好转,证明诊断隐球菌感染正确。隐球菌一旦诊断明确,其治疗手段较多,如前文所说有Amp B、5-FC、氟康唑、伏立康唑等。但本文的病例难度在于,诊断的不明确性,仅靠临床经验诊断以及治疗,反而体现出本文的独特性及启发性。
另外,氟康唑可治疗隐球菌感染,也可治疗大多数假丝酵母菌感染,因此,该病例也不能完全排除假丝酵母菌感染的可能。肺念珠菌病根据发病时间长短可分为急性和慢性两种。急性者影像学表现多数为肺叶、段实变,少数表现为弥漫性粟粒状,在肺实变内可见空洞,粟粒状病灶也可融合成片,类似于肺炎、肺脓肿[22],故不能单凭影像学判断假丝酵母菌感染。本文报道的病例以结节影以及胸腔积液为主要表现,并未见明显的实变空洞等,并且也未寻找到假丝酵母菌的微生物证据。尽管假丝酵母菌感染的影像学表现缺乏特异性,但在一定程度上还是能反映其病理形态学特征,因此,应重视运用影像学方法追踪观察肺部病变的动态改变,如病灶未吸收,或者加重以及出现新的病灶,可提示临床医生及时采样检测[23],比如痰细菌培养,快速多重PCR联合诊断[24-25]能提高诊断率,也能更好的鉴别诊断真菌的类型,毕竟侵袭性真菌病的诊断需要综合多方面因素/结果后才能作出,包括宿主因素,临床标准如影像学改变,以及微生物标准,如痰培养、支气管肺泡灌洗液培养、G实验、GM实验等[26]。
综上所述,HSCT后发热,是很常见的临床症状,临床医生需要积极分析引起发热的原因,最常见的是感染,如本文提到的细菌感染、病毒感染、真菌感染以及一些特殊病原菌感染,同时还需警惕GVHD引起的发热等。对于感染,应积极寻找病原学证据,以针对性地指导治疗。然而,临床诊治工作中,大多数情况下不能寻找到明确的证据,此时经验诊治即显得尤为重要。
| [1] |
Husain S, Wagener MM, Singh N. Cryptococcus neoformans infection in organ transplant recipients:variables influencing clinical characteristics and outcome[J]. Emerg Infect Dis, 2001, 7(3): 375-381. DOI:10.3201/eid0703.017302 |
| [2] |
罗运春, 王强, 李昌崇. 如何认识和治疗儿童肺隐球菌病[J]. 中华儿科杂志, 2009, 47(3): 231-232. DOI:10.3760/cma.j.issn.0578-1310.2009.03.021 |
| [3] |
杜安通, 周兆婧, 郭天阳, 等. 实体器官移植术后隐球菌感染诊治的研究进展[J]. 微生物与感染, 2015, 10(2): 122-126. |
| [4] |
《中国真菌学杂志》编辑委员会. 隐球菌感染诊治专家共识[J]. 中国真菌学杂志, 2010, 5(2): 65-68, 86. DOI:10.3969/j.issn.1673-3827.2010.02.001 |
| [5] |
孙华, 庄少侠, 陆国础, 等. 原发性肺隐球菌病6例报道并文献复习[J]. 中国感染与化疗杂志, 2014, 14(2): 162-163. |
| [6] |
龙显荣, 孟家晓, 余庭山. 肺隐球菌病影像表现与临床分析[J]. 现代医用影像学, 2013, 22(2): 93-95. |
| [7] |
Sun HY, Wagener MM, Singh N. Cryptococcosis in solid-organ, hematopoietic stem cell, and tissue transplant recipients:evidence-based evolving trends[J]. Clin Infect Dis, 2009, 48(11): 1566-1576. DOI:10.1086/600147 |
| [8] |
施毅. 肺隐球菌病的诊治[J]. 中华结核和呼吸杂志, 2009, 32(7): 551-554. DOI:10.3760/cma.j.issn.1001-0939.2009.07.025 |
| [9] |
朱敏, 毕意辉, 武景波, 等. 肺隐球菌病临床误诊讨论[J]. 临床误诊误治, 2015, 28(2): 43-46. DOI:10.3969/j.issn.1002-3429.2015.02.016 |
| [10] |
Mendpara SD, Ustun C, Kallab AM. Cryptococcal meningitis following autologous stem cell transplantation in a patient with multiple myeloma[J]. Bone Marrow Transplant, 2002, 30(4): 259-260. DOI:10.1038/sj.bmt.1703646 |
| [11] |
Miniero R, Nesi F, Vai S, et al. Cryptococcal meningitis following a thrombotic microangiopathy in an unrelated donor bone marrow transplant recipient[J]. Pediatr Hematol Oncol, 1997, 14(5): 469-474. DOI:10.3109/08880019709028778 |
| [12] |
Rimek D, Haase G, Lück A, et al. First report of a case of meningitis caused by Cryptococcus adeliensis in a patient with acute myeloid leukemia[J]. J Clin Microbiol, 2004, 42(1): 481-483. DOI:10.1128/JCM.42.1.481-483.2004 |
| [13] |
Chaaban S, Wheat LJ, Assi M. Cryptococcal meningitis post autologous stem cell transplantation[J]. Transpl Infect Dis, 2014, 16(3): 473-476. DOI:10.1111/tid.2014.16.issue-3 |
| [14] |
Bandettini R, Castagnola E, Calvillo M, et al. Voriconazole for cryptococcal meningitis in children with leukemia or receiving allogeneic hemopoietic stem cell transplant[J]. J Chemother, 2009, 21(1): 108-109. DOI:10.1179/joc.2009.21.1.108 |
| [15] |
Oliver N, Luong T, Tchakarov A, et al. Disseminated cryptococcal infection in allogeneic stem cell transplant patients:a rare cause of acute kidney injury[J]. Bone Marrow Transplant, 2016, 51(10): 1301-1304. DOI:10.1038/bmt.2016.120 |
| [16] |
Aghazadeh K, Nadji SA, Shokouhi S, et al. Concurrent presence of Cryptococcal meningitis and neoplastic meningitis in a recipient of hematopoietic stem cell transplantation:a case report[J]. Arch Clin Infect Dis, 2016, 11(2): e31067. |
| [17] |
Park SS, Lee H, Park WS, et al. A case of disseminated infection with skin manifestation due to non-neoformans and non-gattii Cryptococcus in a patient with refractory acute myeloid leukemia[J]. Infect Chemother, 2017, 49(2): 142-145. DOI:10.3947/ic.2017.49.2.142 |
| [18] |
徐岚, 胡炯, 吴文, 等. 造血干细胞移植后早期侵袭性真菌感染的临床分析[J]. 诊断学理论与实践, 2007, 6(4): 358-361. DOI:10.3969/j.issn.1671-2870.2007.04.017 |
| [19] |
中华医学会感染病学分会艾滋病学组. 艾滋病诊疗指南第三版(2015版)[J]. 中华临床感染病杂志, 2015, 8(5): 385-401. DOI:10.3760/cma.j.issn.1674-2397.2015.05.001 |
| [20] |
李毅, 赵川, 唐坤伦. 多器官新型隐球菌感染1例[J]. 中国保健营养, 2013(11): 600. |
| [21] |
陈莉萍. 实体器官移植术后隐球菌病的研究进展[J]. 器官移植, 2018, 9(1): 9-15. DOI:10.3969/j.issn.1674-7445.2018.01.002 |
| [22] |
王锐, 景中军. 肺白色念珠菌病的临床及影像学表现(附24例报告)[J]. 山东医药, 2002, 42(20): 40-41. DOI:10.3969/j.issn.1002-266X.2002.20.021 |
| [23] |
何卫, 陈文静, 陈宁, 等. 影像学对肺念珠菌病诊断价值分析[J]. 中国感染控制杂志, 2011, 10(2): 116-119, 115. DOI:10.3969/j.issn.1671-9638.2011.02.009 |
| [24] |
李劲松, 宋诗铎, 祁伟, 等. 常见深部念珠菌感染快速基因诊断[J]. 中国感染控制杂志, 2004, 3(3): 198-201. DOI:10.3969/j.issn.1671-9638.2004.03.002 |
| [25] |
肖喻, 曹先伟. 白假丝酵母菌基因分型方法的研究进展[J]. 中国感染控制杂志, 2017, 16(5): 482-486. DOI:10.3969/j.issn.1671-9638.2017.05.021 |
| [26] |
中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第五次修订版)[J]. 中华内科杂志, 2017, 56(6): 453-459. DOI:10.3760/cma.j.issn.0578-1426.2017.06.015 |



